STUDIU. Screeningul genetic în masă, eficient în detectarea persoanelor la risc de a dezvolta hipercolesterolemie familială și două tipuri de sindroame asociate cancerelor ereditare
- Hipercolesterolemia familială (HF) e diagnosticată în jurul vârstei de 48 de ani, iar în forma homozigotă reprezintă o cauză importantă de infarct miocardic la tineri
- Sindromul Lynch presupune un risc înalt de apariție a unor cancere ereditare, dintre care cel mai frecvent e cancerul de colon. Cu toate acestea, se estimează că 95% dintre persoane nu sunt identificate
- 5-10% dintre cazurile de cancer de sân și de ovar sunt cauzate de un sindrom ereditar – HBOC (Hereditary breast–ovarian cancer syndrome). Multe persoane care au mutații acționabile nu sunt diagnosticate din cauza criteriilor de testare genetică restrictive, conform statisticilor Medicare.
Toate cele 3 boli ereditare sunt considerate prioritare conform CDC (Centers for Disease Control and Prevention) pentru screening (tier I genomic application). Cu toate acestea, în practică, riscul genetic este determinat prea târziu, după un diagnostic de cancer sau după ce o persoană suferă un infarct miocardic. Multe persoane la risc nu sunt identificate pe baza ghidurilor clinice actuale.
Un studiu publicat recent în Nature arată că un program de screening populațional poate detecta cu succes persoanele la risc de a dezvolta aceste boli genetice. 90% dintre cazuri nu sunt identificate folosind ghidurile clinice care există în prezent. Datele provin din analizarea unei cohorte din cadrul inițiativei Healthy Nevada Project.
Milioane de persoane la risc ar putea primi informații legate de profilul genetic, informații acționabile, relevante în practică, dar și din perspectiva strategiilor de sănătate publică. O concluzie importantă a studiului este că recomandările din ghidurile actuale sunt limitate și omit multe cazuri de afecțiuni ereditare pentru care intervenția precoce este vitală.
„Aceste rezultate ne permit să înțelegem prevalența unor boli genetice și să ne asigurăm că oferim cele mai bune strategii pentru prevenție și îngrijiri. La nivel individual, aceste date pot schimba viețile oamenilor” – Dr. Anthony Slonim, CEO Renown Health și autor al proiectului
Proiectul Healthy Nevada a fost lansat în 2016, oferind testare genetică gratuită pentru cetățenii cu vârste de peste 18 ani. Au fost colectate date clinice, genetice și legate de factorii de mediu, precum și date socioeconomice. În cei 4 ani s-au înrolat 50.000 de participanți, cel mai rapid ritm al înrolării într-un studiu genetic.
Primele rezultate au fost obținute în 2018, scopul fiind acela de a oferi participanților informații privind prezența anumitor variante care îi predispun la apariția uneia dintre cele 3 afecțiuni genetice. De asemenea, s-a urmărit evaluarea utilității în practică a realizării screeningului în masă pentru identificarea persoanelor la risc.
Cea mai recentă analiză a proiectului Healthy Nevada, publicată în Nature, a inclus o cohortă de 26.960 de participanți. Au identificat 358 de persoane care erau purtători ai unei variante genetice sugestive pentru HBOC, sindromul Lynch sau HF. Dintre aceștia, doar un sfert se încadrau în criteriile din ghidurile clinice pentru screening genetic și peste 20% dintre purtători aveau deja boala instalată și un diagnostic clinic.
Datele sugerează că ghidurile clinice pentru detectarea persoanelor la risc sunt lipsite de acuratețe și eșuează în a identifica grupurile țintă.
Alte rezultate au arătat că:
- Doar 22 dintre cei 273 de purtători ai uneia dintre cele 3 afecțiuni prezentau suspiciune clinică sugestivă pentru boală;
- 63,3 % dintre dosarele pacienților nu menționau date care să sugereze o posibilă etiologie genetică.
Mulți dintre cei identificați ca purtători ai unei variante genetice anormale în cadrul proiectului nu ar fi fost detectați prin metodele clasice de screening (bazate pe istoricul familial sau personal și alte caracteristici demografice).
Sistemul de clasificare CDC
Experții CDC (Centers for Disease Control and Prevention) au formulat recomandări pentru bolile cronice ereditare care ar putea beneficia de testare genetică, sfat genetic și screening în cascadă. Aplicațiile sunt grupate în 3 categorii. În categoriile de gradul I sunt incluse acele afecțiuni pentru care există dovadă clară pentru implementare. Aici sunt incluse acele gene cu penetranță mare (probabilitatea ca boală să apară atunci când există un genotip sugestiv), asocieri clare cu o anumită boală, dar și intervenții eficiente (prevenție sau controlul bolii). Acestea includ sindromul Lynch, hipercolesterolemia familială și sindromul cancerului ereditar de sân și de ovar (HBOC = hereditary breast-ovarian cancer syndrome). Transmiterea acestor boli se face autozomal dominant în majoritatea cazurilor, fiecare copil are 50% șanse să moștenească boala.
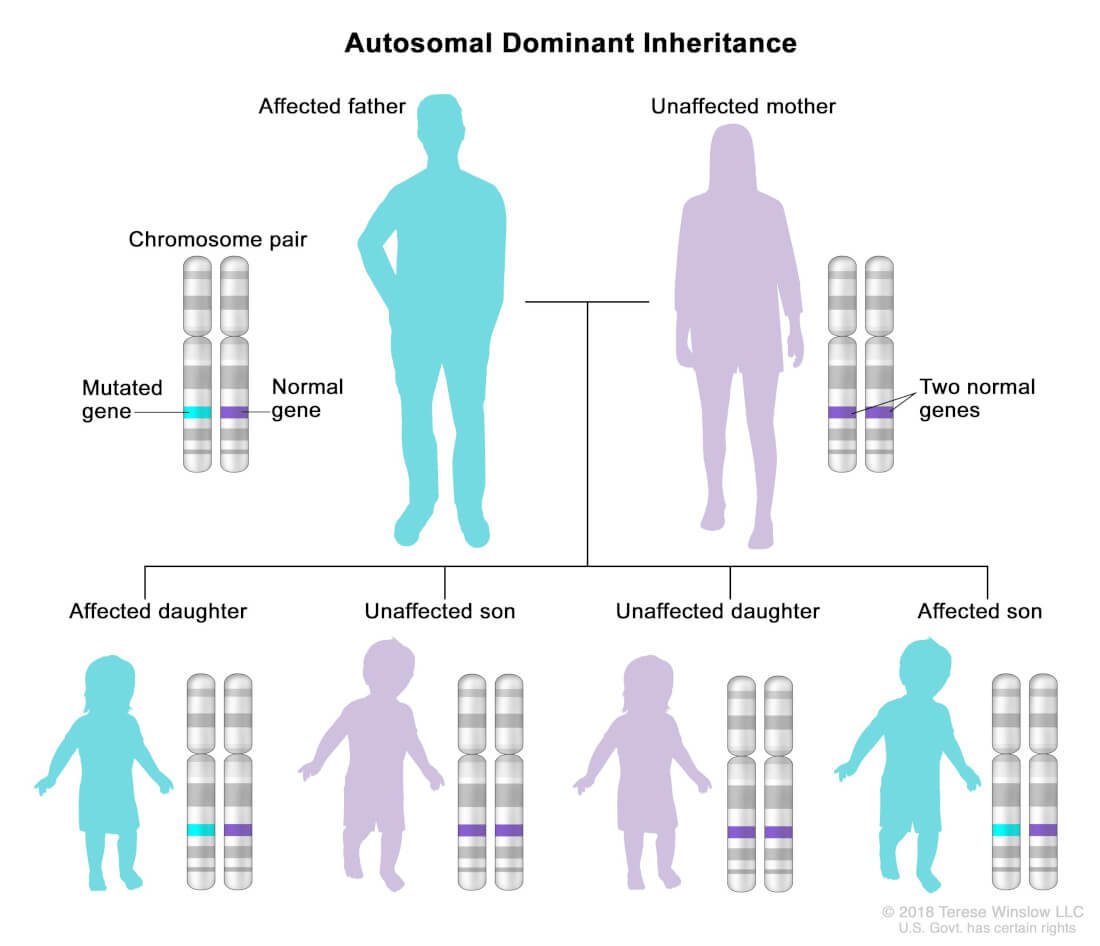
- Gene asociate sindromului Lynch: MLH1, MSH2, MSH6, PMS2, EPCAM;
- HBOC: BRCA1 și BRCA2;
- Hipercolesterolemia familială: LDLR, APOB, PCSK9.
În a doua categorie sunt incluse acele gene care pot fi candidate pentru screening, dar pentru nu există date solide încă. Aici sunt încadrate, de exemplu, multe teste de farmacogenomică.
În a treia categorie intră acele aplicații de tipul testelor adresate direct consumatorului sau alte aplicații pentru care nu există recomandare de implementarea în practică, dar pot fi utile în cercetare.
Bolile genetice prioritare pentru screening
Conform statisticilor din SUA, HBOC și sindromul Lynch afectează între 1 și 2 milioane de persoane. HBOC e determinat de mutații la nivelul genelor BRCA1 și BRCA2. 1 din 500 de femei are o mutație BRCA, ceea ce crește riscul de cancer de sân ovarian și alte cancere. Mutațiile BRCA sunt asociate cu 3% dintre cancerele de sân și 10% dintre cancerele ovariene. Femeile care prezintă mutații BRCA au un risc cuprins între 55 și 70% de a dezvolta cancer de sân și un risc de 17-59% de a dezvolta cancer ovarian până la vârsta de 70 de ani, în timp ce riscul în populația generală este de 12%, respectiv 1,3%. Un studiu publicat recent în JAMA Oncology a demonstrat pentru prima dată faptul că identificarea purtătorilor mutațiilor BRCA1/2 înainte de diagnostic se corelează cu creșterea ratei de supraviețuire.
Mai multe studii prezentate în cadrul ARSBrS (American Society of Breast Surgeons) 2018 arătau faptul că ghidurile clinice actuale pentru cancerul de sân sunt restrictive în ceea ce privește testarea și exclud aproape jumătate dintre pacienții la risc. Cu toate acestea, noi date demonstrează cost-eficiența programelor de screening populațional pentru BRCA1/2, chiar și în țări cu venituri reduse.
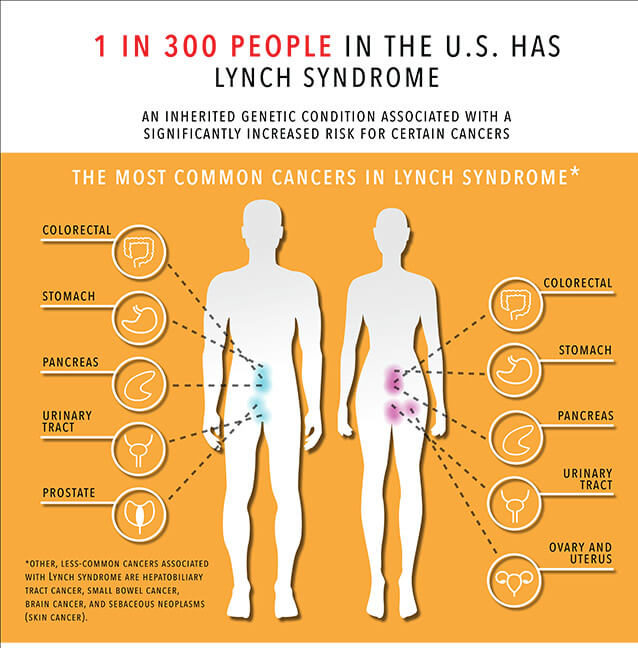
Sindromul cancerului colorectal nonpolipozic ereditar (HNPCC) sau sindromul Lynch este cauzat de modificări la nivelul unor gene implicate în repararea ADN. De-a lungul vieții, persoanele cu sindrom Lynch au un risc de 50-80% de a dezvolta cancer de colon și au un risc de 25% de a avea deja cancer de colon la momentul începerii screeningului. Sindromul Lynch determină și un risc cuprins între 14-71% de apariție a cancerului endometrial. De asemenea, e asociat și cancerului ovarian (un risc între 3-22%), cancerului gastric (13%) și cancerului urotelial (25%).
Un studiu prezentat la ASCO 2018 arată că neoplasmele cu instabilitate microsatelitară înaltă au și o probabilitate mai mare de a fi asociate sindromului Lynch.
Anomaliile de reparare ADN conduc la fenomenul de instabilitate microsatelitară (MSI-H). Diagnosticul se realizează prin identificarea mutațiilor într-una dintre genele MMR – MLH1, MSH2, MSH6 sau PMS2, care sunt implicate în repararea erorilor care apar atunci când ADN-ul este replicat. Pe măsură ce anumite celule anormale continuă să se dividă, acumularea erorilor conduce la creșterea celulară necontrolată, crescând riscul de cancer. Mutațiile la nivelul genei EPCAM conduc la repararea ADN deși nu sunt implicate direct în acest proces. Sindromul Lynch se transmite autozomal dominant, ceea ce înseamnă că o singură copie anormală a genei alterate e suficientă pentru a crește riscul de cancer.
9 din 10 persoane cu hipercolesterolemie familială nu sunt diagnosticate. HF este o afecțiune genetică ce determină decese premature asociate cu boala cardiovasculară aterosclerotică. Deși boala este la fel de frecventă ca diabetul de tip 1, în prezent este subdiagnosticată. În ultimii 20 de ani, au apărut noi opțiuni terapeutice, care au transformat HF într-o boală controlabilă.
O nouă meta-analiză arată că prevalența HeHF (hipercolesterolemia familială hetereozigotă) este de 1:311 în populația generală. 1 din 17 pacienți cu boală cardiovasculară aterosclerotică suferă de fapt, de această boală genetică. Prevalența e similară în toate regiunile OMS evaluate. Studiul aduce informații importante pentru strategiile de sănătate publică, susținând utilitatea screening-ului pentru detecția precoce a persoanelor cu HF. Un alt semnal de alarmă este faptul că în doar 9% dintre țările din întreaga lume se cunoaște prevalența HF.

Medicina genomică este considerată baza pentru inițiativele de realizarea principiilor medicinei de precizie. Cu toate acestea, medicina de precizie înseamnă mai mult de atât.
„Medicina de precizie reprezintă o abordare pentru prevenția și tratamentul bolilor care ia în considerare variațiile care apar la nivel de gene, factori de mediu și stil de viață” – NIH (National Institutes of Health)
Medicina genomică se aplică atât la nivel de interacțiune între pacient și furnizorul de servicii de sănătate, la nivel de familii, comunități, la nivel de sistem de sănătate. Aplicațiile genomicii în prevenție și promovarea sănătății sunt într-o continuă transformare și au un impact și asupra strategiilor de sănătate publică. Intervențiile potrivite asupra unor populații țintă pot reduce povara bolilor cronice.
În ultimele decenii, principala metodă de reducere a morbidității și mortalității în rândul populației afectate de boli genetice a fost reprezentată de screeningul nou-născuților. În SUA, primul program național a început în 1963 pentru a identifica persoanele la risc de a dezvolta fenilcetonurie. Cu toate acestea, progresele în domeniul genomicii justifică dezvoltarea de noi programe, dincolo de screeningul nou-născuților.
Deja există peste 5.000 de boli genetice pentru care bazele moleculare sunt cunoscute. Screeningul pentru boli rare ereditare ar putea identifica boli care altfel ar rămâne nediagnosticate până la apariția simptomelor.
Mai mult decât atât, introducerea testelor genetice adresate direct consumatorului necesită și strategii pentru informare și educație, cu scopul de a stimula consumatorii să ia decizii informate în legătură cu starea lor de sănătate.
În SUA, în 2010, autoritățile în domeniul sănătății publice (US Department of Health and Human Services) au inclus genomica pe lista priorităților pentru strategiile de sănătate publică. De asemenea, în același an, CDC a creat sistemul de clasificare pentru aplicațiile genomice noi care au potențialul de a aduce beneficii pentru sănătatea populației. Pentru că bolile cardiovasculare și cancerul sunt principalele cauze de mortalitate în SUA, fiind însoțite și de o povară economică majoră, screeningul pentru cele trei afecțiuni ereditare, care afectează milioane de persoane, se justifică.
Urmăriți, în videoclipul de mai jos, o emisiune marca Raportuldegarda.ro dedicată temei hipercolesterolemiei familiale, care reprezintă un capitol în cadrul raportului anual State of Innovation realizat de Centrul pentru Inovație în Medicină:
Citește și:
- #ASCO18: Sindromul Lynch, frecvent la persoanele cu tumori cu instabilitate microsatelitară înaltă
- STUDIU. 1 din 17 pacienți cu boală cardiovasculară aterosclerotică prezintă o afecțiune genetică: hipercolesterolemie familială. În peste 90% dintre țările de pe glob nu se cunoaște prevalența HF

