Premiul Nobel pentru Fiziologie și Medicină 2019: descifrarea mecanismelor prin care celulele detectează și răspund la variațiile oxigenului
William Kaelin, Jr., Sir Peter J. Ratcliffe și Gregg L. Semenza sunt laureații Premiului Nobel pentru Fiziologie și Medicină de anul acesta, pentru elucidarea unuia dintre cele mai importante mecanisme fiziologice ale organismului – „modul în care celulele detectează și răspund la nivelul de oxigen disponibil”.

Premiile Nobel sunt acordate începând cu 1901 acelor personalități care aduc cele mai importante descoperiri în beneficiul umanității.
Capacitatea celulelor de a detecta variațiile oxigenului și drept consecință să modifice expresia genică este esențială pentru supraviețuire. Cei trei laureați au identificat căi moleculare esențiale care acționează ca un buton control pentru declanșarea sau oprirea acestor mecanisme. Cercetările contribuie la înțelegerea unor patologii precum anemiile, cancerul sau bolile cardiovasculare, toate asociate cu modificarea aportului de oxigen la nivel celular.

Cum răspund celulele la variațiile oxigenului
Oxigenul contribuie la conversia nutrienților în energie pentru celule. Atunci când aportul de oxigen este insuficient apar mecanisme de adaptare prin care nivelul oxigenul poate fi crescut. Un astfel de mecanism este eliberarea hormonului eritropoietină (EPO) care stimulează producția de hematii (celulele care transportă oxigenul în sânge).
Nivelul oxigenului poate înregistra variații atât în situații fizologice cât și patologice.
Oxigenul distribuit tisular are oscilații temporale și spațiale. Organismul trebuie să răspundă atât la nivel local pentru a compensa variațiile oxigenării prin remodelarea tisulară cum este, de exemplu, cazul regenerării patului vascular după o leziune cât și la nivel sistemic – creșterea ventilației în timpul exercițiului fizic sau la expunere la altitudini mari.
Modul în care genele răspund la fluctuațiile de oxigen de la nivel tisular se traduce prin impactul asupra proceselor precum angiogeneza, inflamația, imunitatea sau dezvoltarea fetală.
În 1882 s-a observat efectele hipoxiei (scăderea aportului de oxigen la nivel tisular), când Paul Bert a demonstrat că expunerea la altitudini înalte determină creșterea eritrocitelor (policitemie). Un secol mai târziu se identifică și bazele moleculare, hipoxia determină creșterea expresiei hormonului eritropoietină în rinichi.
În 1931 Otto Warbug primește Premiul Nobel pentru identificarea mecanismelor enzimatice implicate în respirația celulară iar activitatea științifică a lui Corneille Heymans este recompensată prin Premiul Nobel din 1938 pentru cercetările asupra modului în care sistemul nervos controlează ratele respiratorii prin intermediul receptorilor de la nivelul sinusului carotidian.
Cu 75 de ani în urmă se acorda Premiul Nobel pentru descifrarea mecanismelor implicate în respirația celulară. În era științelor„omice” au fost descifrate mecanismele la nivel de expresie genică.
HIF1 – descoperirea butonului de control molecular care crește sau scade expresia genelor ca răspuns la nivelul de oxigen
Greg Semenza a studiat gena EPO și modul în care acesta este reglată în funcție de prezența oxigenului. Atât Semenza cât și Ratcliffe au descoperit că sensibilitatea la oxigen apare în toate țesuturile, nu doar în rinichi, unde se produce hormonul. Semenza a continuat cercetările asupra componentelor celulare implicate în acest răspuns.

Acesta identifică în anii ‘90 un factor care reglează răspunsurile celulare dependente de oxigen. Factorul a fost izolat în 1995 și denumit HIF (Hypoxia Inducible Factor). HIF controlează mai multe gene implicate în diviziunea celulară, formarea de noi vase de sânge și producerea de eritrocite. HIF este alcătuit din două molecule speciale de legare a ADN-ului – numite factori de transcripție HIF-1α și ARNT (transcripția reprezintă prima etapaă expresiei genice, când informația este copiată din ADN în ARN).
Atunci când există o cantitate de oxigen crescută celulele prezintă o expresie slabă a HIF-1α. Funcția HIF este foarte importantă mai ales în caz de hipoxie (scăderea nivelului oxigenului). Când apare hipoxia, crește HIF-1α astfel încât se produce o cantitate mai mare de eritropoietină.
HIF-1 este rapid degradat în mod normal. Dacă oxigenul are o concentrație normală, HIF-1α este degradat la nivelul proteazomului (componenta celulară responsabilă de degradarea proteinelor, o altă descoperire pentru care s-a acordat Premiul Nobel pentru Chimie 2004). În caz de hipoxie HIF-1 este protejat de la degradare. Pentru ca degradarea să aibă loc, HIF-1α trebuie să fie marcat printr-o altă moleculă cheie, ubiquitina.
În timp ce Semenza și Ratcliff căutau mecanismul prin care ubiquitina se leagă de HIF-1α, cercetările lui William Kaelin contribuie la completarea tabloului.
William Kaelin este profesor la Universitatea Harvard și cercetător în cadrul Dana-Farbet Cancer Center, având ca domenii de interes studierea rolului mutațiilor genelor supresoare implicate în carcinogeneză.

Prof. Kaelin a început să studieze o boală genetică ereditară, boala von Hippel-Lindau (VHL), care crește riscul neoplazic la persoanele cu mutații ale genei VHL. Kaelin identificăă gena von Hippel-Lindau (VHL) care codifică o proteină cu rol supresor tumoral (care împiedică diviziunea și creșterea celulară necontrolată).
Proteina VHL face parte dintr-un complex care marchează proteinele cu ubiquitină și le transformă în ținte destinate degradării în proteazom. Kaelin identifică, astfel, piesa de puzzle lipsă. VHL interacționează cu HIF-1α și este necesar pentru degradarea acestuia când valorile oxigenului sunt normale.
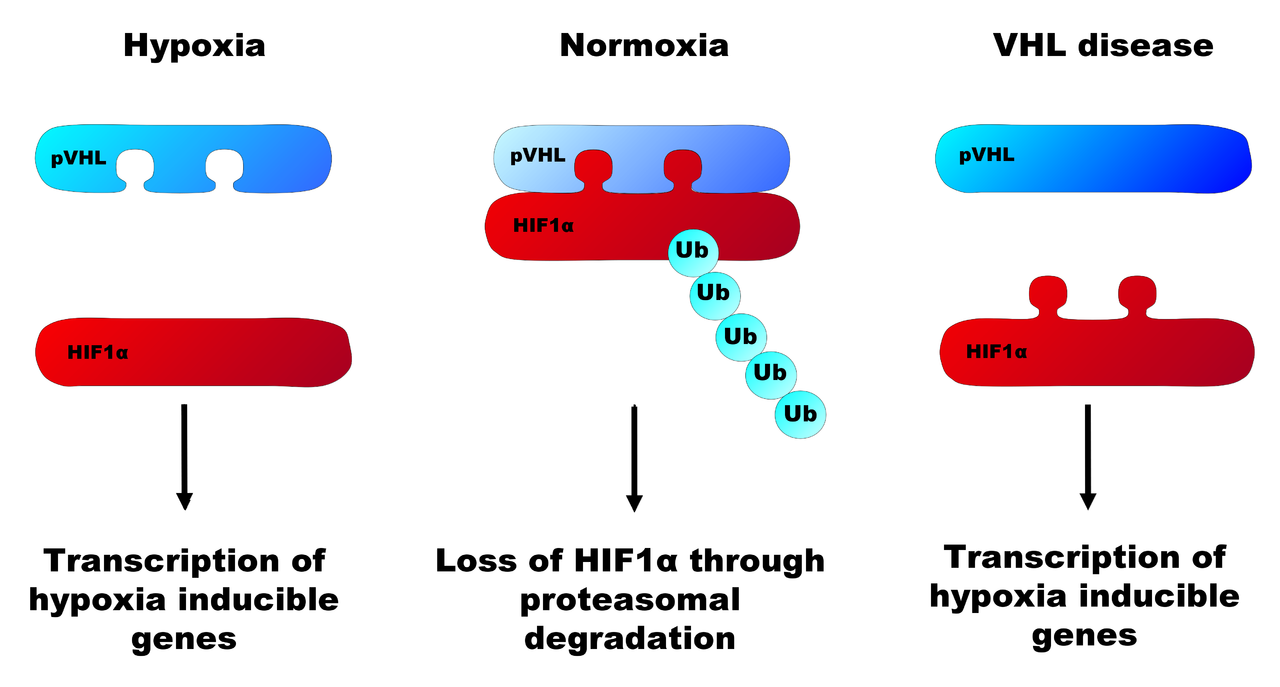
- În caz de hipoxie, HIF-1α nu este degradat, ci se acumulează în nucleu unde se asociază cu ARNT și se leagă de secvențe ADN specifice la nivelul genelor care codifică diferite proteine cu rol de factori de creștere cum este VEGF, care stimulează formarea de noi vase de sânge, fiind un răspund adaptativ.
- Când nivelul oxigenului e normal, HIF e degradat în proteazomi.
- În boala VHL, crește nivelul HIF-1α și prin urmare crește nivelul de factori de creștere ,VEGF PDGF, ceea ce înseamnă, de exemplu, formarea de noi vase de sânge, formarea de matrix extracelular, stimuli asociați carcinogenezei. S-a observat că atunci când se introduce în celulă o genă VHL normală, nivelul factorilor de creștere rămâne normal.
Cercetările lui Sir Peter Ratcliffe, de la Francis Crick Institute din Marea Britanie aduc și mai multe detalii asupra acestei interacțiuni HIF- VHL.
O componentă specifică a HIF-1α este responsabilă de detectarea concentrației oxigenului. Dacă oxigenul are valori normale au loc modificări biochimice (prin intermediul unor enzime numite prolil hidroxilaze) – se adaugă două grupuri hidroxil în poziții specifice ale HIF-1α. Modificarea HIF-1α permite ca VHL să recunoască și să se lege de țintă, astfel încât HIF-1α este degradat.
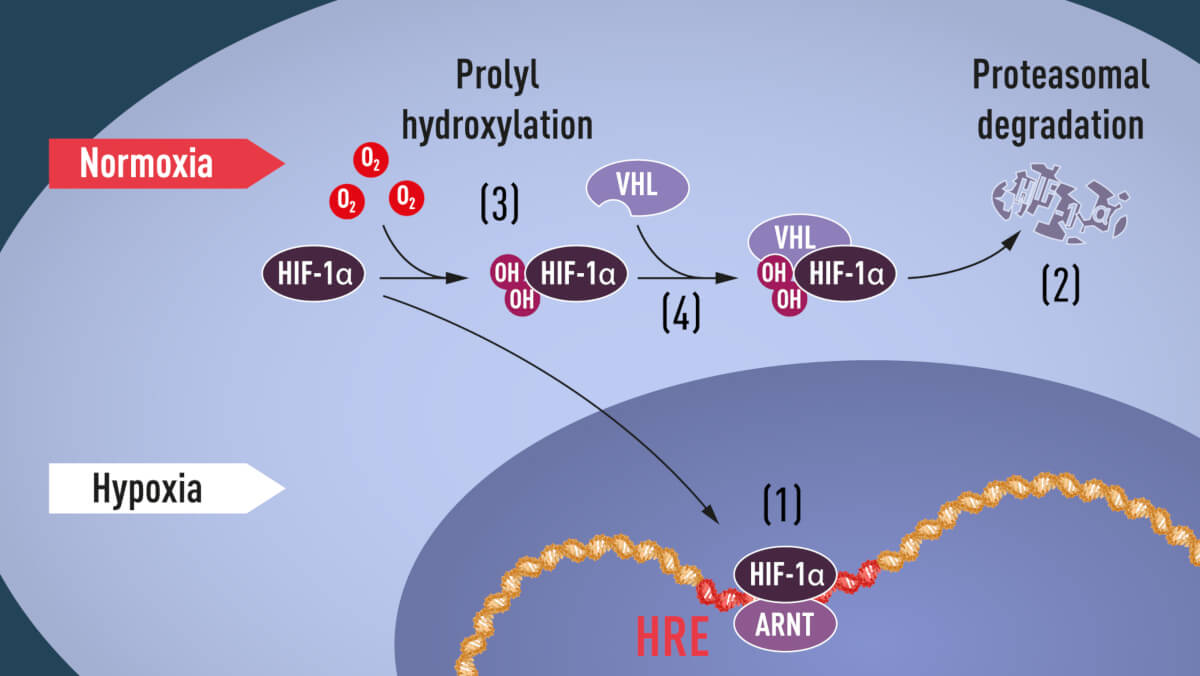
Ratcliff a demonstrat în 1999 că asocierea dintre VHL și HIF1 este de fapt o reacție covalentă dependentă de oxigen. Contribuția lui Ratcliff este legată în mare parte de identificarea acestor enzime dependente de oxigen ( prolil hidroxilaze)

Astfel, s-a demonstrat că modificările expresiei genice sunt direct legate de variațiile oxigenului de la nivel celular.
Cum schimbă descoperirile practica medicală?
Cercetările Laureaților Nobel de anul acesta contribuie la înțelegerea modului în care oxigenul reglează procesele fiziologice esențiale. De asemenea, reprezintă un punct de plecare important pentru identificarea de noi ținte terapeutice.
La pacienții cu insuficiență renală apare anemia din cauza scăderii expresiei EPO. Inhibitorii de prolil hidroxilaze sunt studiați ca tratamente pentru anemie și insuficiență cardiacă, iar primele medicamente au fost deja aprobate în China.
În cazul cancerului, celulele maligne se folosesc de mecanismele adaptative pentru a forma noi vase de sânge și a-și asigura aportul de oxigen necesar pentru a crește. Blocarea acestui fenomen în celulele tumorale poate reprezenta o strategie pentru dezvoltarea de noi terapii antineoplazice. Conform comitetului Nobel, eforturile sunt direcționate în viitor asupra descoperirii de tratamente care activează sau blochează căile prin care celula detectează variațiile oxigenului.
Citește și
- Premiul Nobel pentru Medicină 2018: înțelegerea mecanismelor prin care sistemul imun luptă împotriva cancerului
- Premiul Nobel pentru Medicină 2017: descifrarea mecanismelor ceasului biologic al organismului uman

