FDA lansează primul plan de acțiune care vizează dispozitivele medicale ce au la bază software-uri de inteligență artificială sau machine learning
Food and Drug Administration a lansat primul plan de acțiune care vizează dispozitivele medicale ce au la bază software-uri de inteligență artificială sau machine learning (Artificial Intelligence/Machine Learning (AI/ML)-Based Software as a Medical Device (SaMD) Action Plan).
Documentul cuprinde 5 strategii care subliniază inițiativa agenției de a crea un cadru care să permită monitorizarea îndeaproape a dezvoltării dispozitivelor medicale de acest tip, precum și a modului în care acestea funcționează și influențează calitatea tratamentului pacienților.
Planul de acțiune al FDA a apărut drept răspuns la feedback-ul primit din partea stakeholderilor, cu privire la documentul emis de agenție în urmă cu doi ani: Proposed Regulatory Framework for Modifications to Artificial Intelligence/Machine Learning-Based Software as a Medical Device.
„Planul conturează o inițiativă holistică, concentrată pe monitorizarea întregului ciclu de viață a unui produs pe bază de inteligență artificială sau machine learning, pentru a putea asigura potențialul enorm pe care aceste tehnologii îl prezintă în îmbunătățirea tratamentului pacienților. Anticipăm faptul că acest plan de acțiune va continua să fie dezvoltat, pentru a putea rămâne la curent cu noutățile în domeniu și a putea adresa siguranța pacienților și îmbunătăți accesul acestora la astfel de tehnologii” – afirmă Bakul Patel, director al Digital Health Center of Excellence, în cadrul Center for Devices and Radiological Health (CDRH)
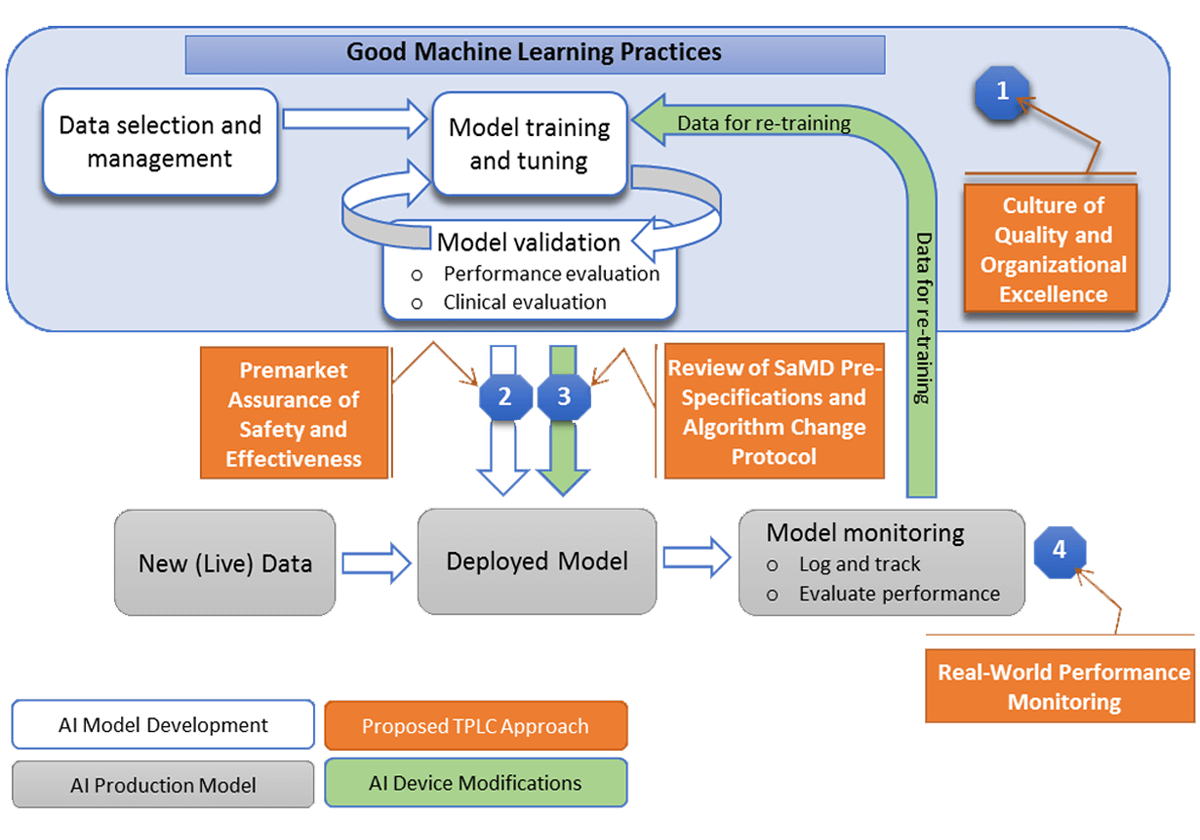
Planul de acțiune dezvoltat de FDA cuprinde 5 strategii principale:
- Actualizarea continuă a cadrului de reglementare a dispozitivelor medicale care au la bază software-uri de inteligență artificială sau machine learning;
- Dezvoltarea bunelor practici în materie de machine learning pentru dezvoltarea și îmbunătățirea algoritmilor;
- Adoptarea unei inițiative centrate pe pacient care să se concentreze pe transparență între modul de funcționare al dispozitivelor și utilizator;
- Dezvoltarea metodelor de evaluare și îmbunătățire a algoritmilor de machine learning;
- Dezvoltarea metodelor de monitorizare a performanței dispozitivelor în viața reală.

Conform unui studiu publicat în jurnalul Digital Medicine, Nature, până în anul 2020 Food and Drug Administration a aprobat 29 de dispozitive medicale bazate pe inteligență artificială sau algoritmi de machine learning, în condițiile în care, până în anul 2019 erau aprobate numai 14, conform unui alt studiu publicat în Nature Medicine. Odată cu dezvoltarea acestui domeniu, nevoia unui cadru adecvat de reglementare devine din ce în ce mai vizibilă.
La începutul anului trecut FDA a aprobat un software bazat pe inteligență artificială, care, integrat într-un dispozitiv care realizează ecografii cardiace, nu numai că ghidează cadrele medicale în efectuarea unei scanări, ci și îmbunătățește semnificativ calitatea imaginilor rezultate.
Momentul aprobării acestui dispozitiv a marcat prima inițiativă în care producătorul a utilizat un Plan de Control al Schimbărilor Predeterminate (Predetermined Change Control Plan), plan care susține încorporarea diverselor modificări ulterioare.
Unul dintre principalele avantaje ale dispozitivelor medicale pe bază de software AI/ML se regăsește în capacitatea acestora de a „învăța” aspecte din viața reală și de a-și îmbunătăți abilitățile și performanțele pe baza acestor informații.
Strategiile planului de acțiune
Actualizarea cadrului de reglementare pentru dispozitivele medicale AI/ML
Învățarea continuă, adaptarea și optimizare reprezintă trei dintre cele mai importante caracteristici ale unui dispozitiv medical pe bază de inteligență artificială sau machine learning. Totuși, după autorizarea unui astfel de dispozitiv de către FDA, aceste caracteristici sunt considerate modificări. În această idee, agenția a dezvoltat drept primă strategie a planului de acțiune, actualizarea cadrului de reglementare pentru dispozitivele medicale pe bază de software AI/ML.
Mai mult decât atât, datorită interesului crescut din partea stakeholderilor și a comunității în sine în soluționarea acestei limitări, pe parcursul anului 2021 FDA urmează să lanseze un document care va servi drept ghid în acest sens. Documentul va include propuneri despre ce ar trebui inclus în Pre-Specificațiile Sistemelor medicale care funcționează pe baza software-urilor AI/ML (SPS – SaMD Pre-Specifications) și în Protocolul de Schimbare a Algoritmului (ACP – Algorithm Change Protocol) astfel încât să se asigure siguranța și eficiența algoritmilor de la baza acestor sisteme.
Dezvoltarea bunelor practici în materie de machine learning
Când vine vorba despre algoritmii de machine learning, bunele practici se referă la aspecte inginerești și de calitate a sistemelor precum managementul datelor, antrenarea algoritmului, interpretabilitate, evaluarea și documentarea.
Implementarea unor seturi de practici standardizate va aduce avantaje atât prin ghidarea industriei și a dezvoltării produselor, cât și pentru producători în sine. În acest context, FDA va încuraja dezvoltarea armonioasă a seturilor de bune practici.
Adoptarea unei inițiative centrate pe pacient
FDA dorește să sprijine o inițiativă centrată pe pacient, o inițiativă care să se poată baza pe transparență între modul de funcționare al unui dispozitiv medical pe bază de software AI/ML și utilizator. În acest sens, utilizatorii vor putea înțelege beneficiile, riscurile și limitările acestor sisteme medicale. Această inițiativă este necesară deoarece algoritmii utilizați în astfel de dispozitive se pot actualiza în timp, învățând diverse aspecte noi.
Având ca punct de plecare această idee, în octombrie 2020 FDA a susținut o întâlnire dedicată pacienților (Patient Engagement Advisory Comittee) pentru a obține informații în legătură cu factorii care influențează utilizatorii să aibă încredere în astfel de tehnologii.
Dezvoltarea metodelor de evaluare și îmbunătățire a algoritmilor
Food and Drug Administration va sprijini eforturile de reglementare științifică în ceea ce privește dezvoltarea unei metodologii de evaluare și îmbunătățire a algoritmilor de machine learning, inclusiv pentru identificarea și eliminarea anumitor elemente de părtinire sau prejudecăți. Este extrem de important ca aceste dispozitive medicale bazate pe software AI/ML să fie potrivite pentru o populație de pacienți variată din punct de vedere etnic și rasial.
Dezvoltarea metodelor de monitorizare a performanței dispozitivelor în viața reală
Datele și informațiile provenite din viața reală cu privire la dispozitivele medicale bazate pe software AI/ML sunt neprețuite. Colectarea și monitorizarea acestor date ajută atât la îmbunătățirea serviciilor oferite, cât și la aflarea nevoilor utilizatorilor pentru viitoare dezvoltări de sisteme și dispozitive.
Citește și:
- Un algoritm bazat pe inteligență artificială (AI) poate prezice structura tridimensională a unei proteine, pornind de la secvența genetică
- FDA aprobă Fitbit ECG, aplicație mobilă utilizată pentru monitorizarea ritmului cardiac și detectarea fibrilației atriale
- FDA aprobă NightWare, prima terapie digitală pentru controlul coșmarurilor la persoanele cu tulburare de stres post-traumatic

