Alecensa (alectinib) primește aviz pozitiv pentru aprobarea în UE ca monoterapie de linia I pentru carcinomul pulmonar non-microcelular (NSCLC), ALK pozitiv
Comitetul pentru produse medicamentoase de uz uman (CHMP), din cadrul Agenţiei Europene a Medicamentului (EMA) a emis un aviz pozitiv, ce recomandă aprobarea medicamentului Alecensa (alectinib) ca monoterapie pentru linia întâi de tratament al carcinomului pulmonar fără celule mici (NSCLC, non-small cell lung carcinoma), ALK pozitiv.
CHMP recomandă, de asemenea, Alecensa ca tratament de linia a doua (în caz de eșec al răspunsului la crizotinib) și transformarea autorizației de comercializare condiționată în autorizație de punere pe piață completă.
Decizia CHMP se bazează pe studiul global de fază III ALEX, care a demonstrat că terapia țintită cu Alecensa, un inhibitor ALK (kinaza limfomului anaplastic) are un efect superior în ceea ce privește supraviețuirea, față de crizotinib (Xalkori), un medicament din aceeași clasă dar care apariține unei generații mai vechi.
Rezultatele studiului:
- Alecensa a redus riscul de progresie a bolii sau rata decesului cu 53% comparativ cu crizotinib
- supraviețuirea fără progresie a bolii conform Independent Review Committee (IRC) a fost de 25,7 luni pentru Alecensa și de 11,1 luni pentru crizotinib
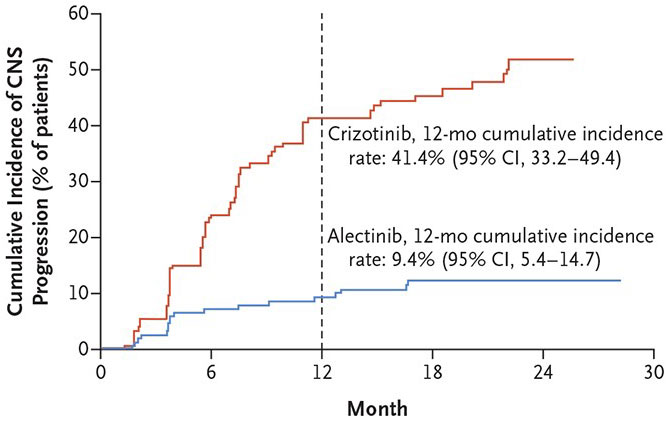
- Alecensa reduce riscul de apariție a metastazelor la nivelul sistemului nervos central (SNC) cu 84%
- reacțiile adverse au fost mai puțin frecvente în grupul care a primit Alecensa (41%), comparativ cu grupul care a primit crizotinib (50%);
ALEX este un studiu multicentric, randomizat, de fază III care a inclus 303 persoane din 31 de țări. S-au comparat cele 2 terapii țintite, Alcensa și Xalkori după criteriile de eficacitate și siguranță la pacienții cu NSCLC, ALK pozitiv, netratat anterior. Mutațiile la nivelul genei ALK (kinaza limfomului anaplastic) au fost identificate prin testul de imunohistochimie VENTANA ALK (D5F3) CDx Assay dezvoltat de Roche și aprobat de FDA. Obiectivul principal a fost rata de supraviețuire fără progresie a bolii.
Rata de exindere a procesului malign la nivelul sistemului nervos central pe o perioadă de 12 luni la persoanele cu sau fără metastaze pre-existente a fost de 9,4% pentru pacienții tratați cu Alecensa comparativ cu 41,4%, la cei tratați cu crizotinib.
Reacțiile adverse (RA) de grad 3-5 au fost mai puțin frecvente în grupul care a primit Alecensa (41%), față de grupul care a primit crizotinib (50%). Cele mai întâlnite RA asociate cu Alecensa au fost creșterea enzimelor hepatice (ALT și AST) și anemia. De asemenea, RA care au determinat reducerea dozelor, întreruperea tratamentului au fost mai scăzute în grupul Alecensa.
ALK (kinaza limfomului anaplastic) este o proteină implicată în procese de semnalizare la nivel celular. Mutația genei care codifică ALK este prezentă la aproximativ 5% dintre pacienții cu NSCLC. Carcinomul pulmonar non-microcelular ALK pozitiv este mai frecvent la pacienții tineri, nefumători sau care au un istoric nesemnificativ de consum de tutun. Se asociază mai ales cu forma de adenocarcinom.
Din prima generație de inhibitori ALK face parte crizotinib, aprobat în 2013 de FDA pentru NSCLC metastatic, ALK pozitiv, medicament ce a devenit rapid un standard în tratarea acestui tip de cancer pulmonar care până atunci avea puține opțiuni terapeutice. Cu toate acestea, eficiența medicamentului s-a dovedit limitată:
„Crizotinib este eficient inițial, însă pentru cei mai mulți pacienți boala progresează din primul an de tratament. Sistemul nervos central este una dintre zonele cele mai afectate, ceea ce arată că medicamentul are o penetranță slabă la nivelul creierului” – Dr. Alice Shaw, Massachusetts General Hospital, Boston
A doua generație de inhibitori ALK, din care fac parte alectinib și ceritinib depășește această limitare. Alectinib a dovedit atât o eficiență mai bună cât și un profil de siguranță superior crizotinib.
Alecensa, medicament produs de compania Roche, a fost aprobată de FDA în decembrie 2015 pentru pacienții cu NSCLC avansat, ALK pozitiv care nu au tolerat tratamentul cu crizotinib. A primit aprobare condiționată de la EMA pentru aceeași indicație în februarie 2017, ceea ce înseamnă că erau așteptate date din studii care să confirme un raport favorabil risc – beneficiu.
Următorul pas este ca EMA să ia decizia finală de aprobare și Alecensa să devină în Europa atât prima linie de tratament cât și principal opțiune în caz de eșec al tratamentului cu crizotinib.
Mai multe informații pe tema tratamentului carcinomului pulmonar non-microcelular :
- #ESMO17: Alectinib, beneficiu pentru pacienții cu cancer pulmonar fără celule mici, cu metastaze cerebrale
- Tecentriq, aprobat ca monoterapie pentru tratarea cancerului pulmonar și a cancerului urotelial
- #ESMO17: Tagrisso, noul standard în tratarea cancerului pulmonar non-microcelular, EGFR-pozitiv

