#ASCO2017: Testarea genomică de rutină este fezabilă, dar numai o parte a pacienților beneficiază de ea în mod curent
Studiul ProfiLER, realizat în Franța pe un număr de 1.944 de pacienți care aveau cancer în stadiu avansat, sugerează că accesul la testarea genomică de rutină este fezabil, chiar dacă în momentul actual doar un număr redus de pacienți se bucură de beneficiile ei clinice. Potrivit realizatorilor, este cel mai mare studiu de acest fel întocmit până în prezent și a fost prezentat cu ocazia Întâlnirii Anuale a Societății Americane de Oncologie Clinică (ASCO).
„ Acest studiu demonstrează siguranța utilizării genomicii în practica clinică reală și arată că aceasta ar putea să ghideze alegerea tratamentului pentru pacienții cu cancer în stadiu avansat. Datele studiului sunt interesante mai ales că au fost aprobate imunoterapii noi pentru pacienții care dovedesc instabilitate genomică”, a spus expertul ASCO, Dr. Sumanta Kumar Pal.
Testarea genomică a mostrelor de țesut tumoral poate facilita alegerea tratamentului personalizat dacă acest tratament este corelat cu schimbările genetice din tumoră. Deși un număr tot mai ridicat de pacienți care suferă de cancer în stadiu final beneficiază de anumite testări genomice comprehensive, acestea nu sunt încă utilizate în testarea de rutină.
Autorii studiului au descoperit o mutație „acționabilă” în 52% dintre mostrele de țesut tumoral testate (aceste mutații „acționabile” sunt de fapt schimbări genetice care teoretic pot fi corelate cu terapiile țintite). Consiliul de experți din cadrul studiului a recomandat tratamente țintite pentru 676 de pacienți, iar unui număr de 143 dintre aceștia li s-a administrat tratamentul recomandat. Rata de supraviețuire la cinci ani a fost mai crescută în rândul pacienților care au primit tratamentul recomandat de către Consiliu (34,8%), decât în rândul celor care nu au primit tratamentul (28,1%).
„ Studiul confirmă că profilarea genomică comprehensivă poate fi utilizată în practica de rutină pentru selecționarea pacienților cu cancer care urmează să fie tratați prin terapii țintite”, a spus conducătorul și autorul studiului, Dr. Olivier Tredan, șeful Departamentului de Oncologie Medicală în cadrul Centrului Léon Bérard din Lyon, Franța. „Tehnologia este disponibilă tuturor și necesită doar o cantitate mică de material genetic. Teoretic, am putea efectua această testare pentru fiecare pacient din Franța”.
ProfiLER este un studiu clinic aflat încă în desfășurare care utilizează profilarea genomică a tumorilor pentru ghidarea în vederea aplicării tratamentelor potrivite pentru bolnavii care suferă de cancer în stadiu avansat. ADN-ul din mostrele de țesut tumoral este analizat cu ajutorul noii generații de secvențiere pentru 69 de gene specifice cancerului și hibridizării genomice a unui genom întreg de comparație. Ambele tehnologii sunt disponibile atât în Franța, cât și în lumea întreagă, susțin autorii studiului.
Consiliul multidisciplinar de experți se reunește săptămânal pentru a verifica rezultatele testării genomice, iar dacă sunt găsite mutații acționabile, oferă recomandări pentru terapiile moleculare țintite.
„Recomandăm terapii moleculare țintite pacienților la care s-au observat mutații în structurile canceroase care ar putea fi tratate fie cu medicamentele deja disponibile pe piață, fie cu cele care se află în studii clinice”, a declarat Dr. Tredan.
Până la momentul actual, 2.676 de pacienți s-au înrolat în studiu și 1.944 de tumori au fost analizate, incluzând tumori colorectale, ginecologice, de sân, cerebrale, la nivelul gâtului, dar și sarcomul. Mutații acționabile au fost găsite în 1.004 (52%) dintre mostrele de țesut tumoral; 609 dintre pacienți au avut un singur tip de mutație, iar 394 au avut peste două și până la șase tipuri de mutații. Cea mai întâlnită a fost mutația PI3K/mTOR.
Consiliul a recomandat tratamente moleculare țintite pentru 676 de pacienți dintre cei 1.944 testați, bazându-se pe proprietatea medicamentelor de a acționa fie asupra proteinei țintite, fie asupra căii pe care aceasta activează. Dintre cei 676, 143 de pacienți au primit tratamentul recomandat, majoritatea prin înrolarea în studii clinice unde noi medicamente erau testate. Restul de 533 de pacienți nu au primit tratamentul din cauza sănătății precare sau a progresiei prea rapide a cancerului, nefiind astfel eligibili pentru un studiu clinic de testare a unui nou medicament.
Autorii studiului au comparat rata de supraviețuire a celor 143 de pacienți care au primit terapiile țintite bazate pe testarea genomică cu rata de supraviețuire pentru cei 502 de pacienți care nu au primit terapia, ci au fost tratați prin metode clasice. La trei ani, 53,7% dintre cei care au fost tratați prin terapie selectată genomic erau în viață, spre deosebire de 46,1% dintre cei tratați clasic. Rata de supraviețuire a fost chiar mai ridicată după cinci ani pentru cei care au primit terapia selectată genomic.
În viitor, cercetătorii plănuiesc realizarea unui nou studiu clinic randomizat, ProfiLER02, care va compara testul celor 69 de gene utilizat în primul studiu ProfiLER cu un test de 315 de gene promovat comercial. Studiul ar trebui să evidențieze dacă testarea pentru un număr mai mare de gene conduce către alegerea unei terapii țintite mai bune.
Despre terapiile țintite:
Terapia țintită este un tratament împotriva cancerului care folosește medicamente specifice și este diferită de tradiționala chimioterapie. Medicamentele recunoscute ca terapii țintite ajută la oprirea răspâdirii cancerului și a creșterii numărului de celule canceroase. Funcționează prin identificarea de gene specifice sau proteine care se găsesc în celulele canceroase sau în celulele care stimulează înmulțirea celulelor canceroase, cum ar fi vasele de sânge.
Medicii utilizează terapiile țintite împreună cu chimioterapia sau alte tratamente. În ultima vreme, FDA (Food and Drug Administration) a aprobat astfel de terapii țintite pentru o gamă largă de tipuri de cancer. De asemenea, multe astfel de medicamente se află în studii clinice pentru obținerea aprobării.
Pentru a înțelege cum funcționează aceste terapii, trebuie să știm că fiecare țesut din corpul nostru este alcătuit din celule. Există multe tipuri de celule, de la celulele pielii care formează învelișul nostru exterior, până la celulele creierului. Fiecare celulă, în funcție de țesutul de care aparține are o funcție diferită în organism. Cancerul începe atunci când anumite gene specifice din celule, până la acel moment, sănătoase, încep să se schimbe. Această schimbare este denumită mutație.
Genele dictează celulelor cum să sintetizeze proteinele care ajută la funcționarea lor. Dacă genele suferă o schimbare, aceste proteine se schimbă, de asemenea. Acesta este motivul pentru care celule încep să se dividă anormal sau să trăiască prea mult în corpul nostru. O dată cu diviziunea haotică, celulele care supraviețuiesc în plus formează o tumoră.
Cercetătorii au descoperit că anumite mutații de gene conduc la dezvoltarea anumitor tipuri de cancere. Prin urmare, se urmărește dezvoltarea de medicamente care țintesc aceste schimbări ale genelor și pot:
- Bloca sau dezactiva semnalele care dictează celulelor canceroase să se dividă și să crească
- Opri celulelor din a avea un ciclul de viață mai lung decât ar fi normal
- Elimina celulele canceroase
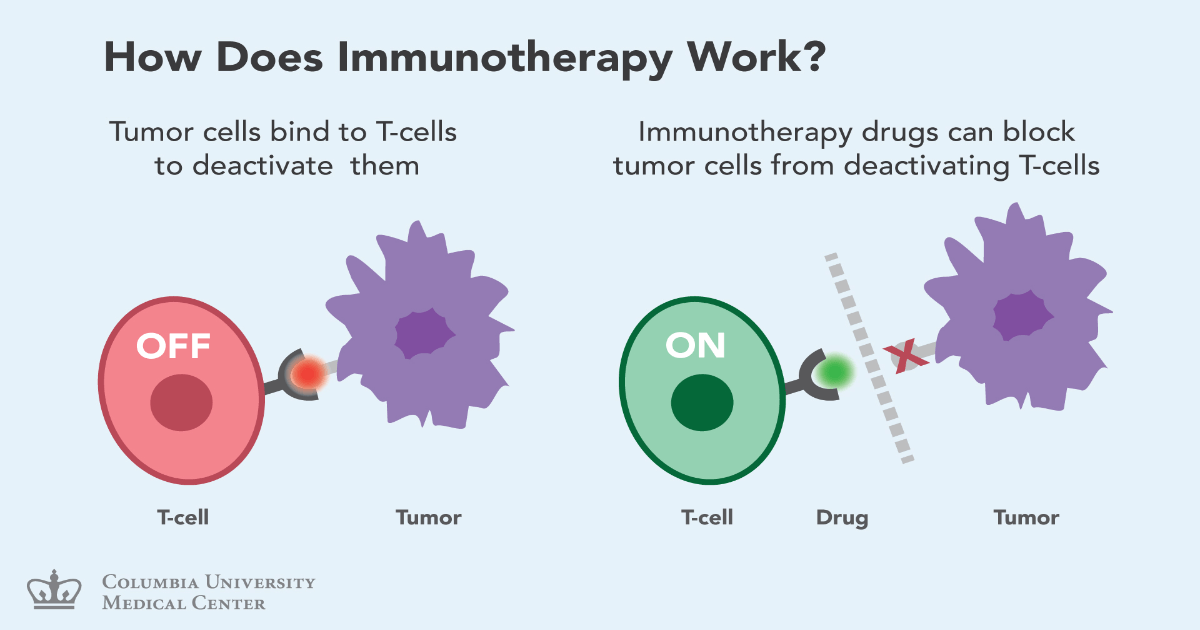
Funcționarea imunoterapiei: – celulele T se leagă de celulele canceroase pentru a le dezactiva
– medicamentul împiedică celulele canceroase din a dezactiva celulele T
Există două tipuri de terapii țintite principale:
- Anticorpii monoclonali– substanțe care blochează o genă specifică din afara celulei canceroase sau din zona apropiată a tumorii. Aceste substanțe funcționează ca o izolare cu material plastic efectuată pentru a bloca scurgerea de energie electrică. Anticorpii monoclonali pot de asemenea trimite substanțe toxice direct către celula afectată. De exemplu, acești anticorpi pot ajuta chimioterapia și radioterapia să ajungă mai rapid la celulele canceroase. De obicei, aceste medicamente se administrează intravenos.
- Moleculele mici– acestea pot bloca direct procesul care conduce la multiplicarea și răspândirea celulelor canceroase. Se administrează de obicei sub formă de pilule. Un exemplu de astfel de terapie țintită sunt inhibitorii angiogenetici care împiedică vascularizarea țesutului din jurul tumorii. Angiogeneza este denumirea dată formării de noi vase de sânge. O tumoră are nevoie de vascularizație pentru a primi nutrienții necesari dezvoltării și răspândirii ei. De aceea, inhibitorii angiogenetici „înfometează” tumora împiedicând formarea de vascularizații în jurul ei.
Este de reținut însă, că nu toate tumorile au aceleași mutații pe care se poate acționa. Așadar, același tratament țintit nu funcționează pentru toată lumea. De exemplu, o genă numită „KRAS” controlează creșterea și răspândirea tumorii. Aproximativ 40% dintre cancerele colorectale au această mutație. În acest caz, terapiile țintite cu cetuximab (Erbitux) și panitumumab (Vectibix) nu funcționează. De aceea, testarea pentru KRAS poate ajuta medicul în prescripția unui tratament potrivit și poate scuti pacientul de timp și resurse pierdute, dar și de efecte adverse.
Sursa: Cancer.net
Sursa foto:

