#ASCO2017: Viitorul imuno-oncologiei: cum transformăm cancerele “reci” în tumori “calde”?
Imuno-oncologia (I-O) face diferența în abordarea cancerului, fiind singurul mijloc terapeutic care nu vizează tumora direct ci determină organismul sa lupte împotriva cancerului prin activarea sistemului imun. Tratamentul este însă eficient pentru mai putin de 50% dintre pacienți, în ciuda progreselor din ultimii ani.
Bristol-Myers Squibb (BMS), o companie biofarmaceutică axată pe tratamente inovatoare, încearcă să afle de ce unii pacienți răspund la I-O si alții nu, plecând de la principiile medicinei translaționale. Concluziile au au fost prezentate la un simpozion organizat în timpul desfășurării Congresului Asociației Americane pentru Oncologie Clinică 2017 de la Chicago.
Unul dintre motivele pentru care I-O nu funcționează la fel pentru toți bolnavii este sugerat de teoria tumorilor „calde” și „reci”. Celulele canceroase care au mutații multiple reprezintă ținte pentru sistemul imun, concentrarea limfocitelor T fiind aici maximă și alcătuind ceea ce se numește o „tumoră caldă”. La polul opus, acolo unde mutațiile nu sunt exprimate, există o densitate scazută a infiltratului inflamator, tumorile fiind considerate „reci ”.
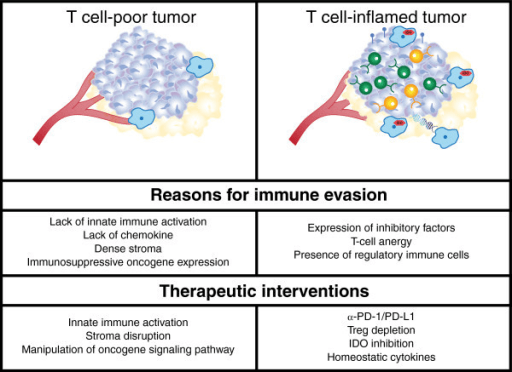
Aceste principii s-au studiat cel mai mult în cancerul colorectal, dar vor fi aplicate și pentru alte tumori solide. Pentru a cuantifica infiltratul inflamator s-a folosit Imunoscore, un sistem modern, superior stadializării clinice TNM, care detectează concentrarea limfocitelor CD8+ si CD3+. S-a observat că dacă în cazul unei tumori „calde”, în stadiu incipient, se practică rezecția chirurgicală, șansele de recurență sunt mici pentru că sistemul imun este activat. După îndepartarea unei tumori „reci” însă, prognosticul e rezervat iar metastazele se pot dezvolta pentru că sistemul imun nu le detectează.
Pentru cancerele cu densitate mare a infiltratului inflamator, noua clasă de medicamente numite checkpoint inhibitors (inhibitori ai punctelor de control) a revoluționat terapia unor tipuri de cancer. PD-1 (Programmed Death-1), de exemplu, este un biomarker aflat în centrul atenției lumii medicale în ultimul timp, inhibitorii acestuia precum Nivolumab (Opdivo) sau Pembrolizumab (Keytruda) reprezentând medicamente care au crescut speranța de viață a pacienților cu melanom malign, cancer pulmonar fără celule mici(NSCLC) sau limfom Hodgkin.
Trei mecanisme au fost identificate de catre Nils Lonberg, vicepreședinte al departmentului Oncology Biology Discovery de la BMS, care explică dificultățile abordărilor terapeutice în imuno-oncologie și, mai ales, cu referire la tumorile „reci”:
- mutațiile unei linii canceroase pot să nu fie exprimate
- raspunsul inflamator nu e susținut suficient astfel încat activitatea celulelor T e sistată înainte de a fi eliminate celulele maligne
- apariția continuă de noi mutații este o regula în carcinogeneză.
Jason Luke, medic oncolog și profesor la Universitatea din Chicago, a discutat în cadrul simpozionului despre importanța manipulării tumorilor în care nu se concentrează limfocitele T :
„Viitorul imuno-oncologiei este să descopere cum să transforme tumorile reci în tumori calde astfel încât să putem prescrie medicamente precum anti-PD1 care și-au dovedit eficiența în vindecarea anumitor pacienți”.
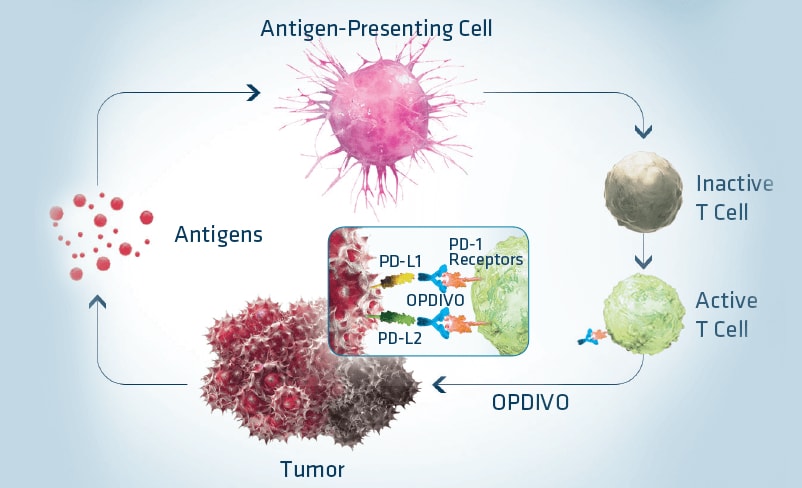
Obiectivul este creșterea procentului de pacienți care beneficiază de tratamentul cu checkpoint inhibitors. Dar aceasta nu se realizeaza doar prin intervențiile asupra mutațiilor celulei canceroase sau densitații neo-antigenelor. Cele mai recente demersuri știintifice vizează modificarea micro-mediului din jurul tumorii. STING (stimulator of interferon genes) este considerat un biomarker de referință pentru viitor deoarece agoniștii săi, administrați inaintea unui checkpoint inhibitor pot crește nivelul de interferon tip I, având ca rezultat un acces mai bun al limfocitelor T la nivelul țesutului neoplazic.
Mai multe detalii despre tema medicinei translaționale, abordată în cadrul conferinței BMS – aici

