Premiul Nobel pentru Chimie 2020: dezvoltarea tehnologiei de editare genomică CRISPR-Cas9
UPDATE 8 decembrie 2020: Prelegerile laureaților Premiului Nobel pentru Chimie 2020
Premiul Nobel pentru Chimie 2020 a fost acordat pentru pentru dezvoltarea metodei de editare genomică CRISPR/Cas9. Emmanuelle Charpentier și Jennifer Doudna sunt laureații Premiului Nobel pentru Chimie de anul acesta.
Jennifer Doudna: „În contextul pandemiei COVID-19 a fost dezvoltată o aplicație a tehnologiei CRISPR-Cas care ar putea permite diagnosticul rapid”. Mai multe detalii în curând pe Raportuldegardă.ro
Jennifer Doudna: „Pentru editarea genomică folosind CRISPR-Cas9 contează tipul de celulă care este modificată – celule somatice sau germinale. Dacă celulele somatice sunt modificate nu pot fi transmise de-a lungul generațiilor. Dacă sunt modificate celulele germinale, sunt influențate și alte generații.
Cred că oportunitatea de a modifica celulele somatice poate conduce la o mulțime de aplicații în nenumărate tipuri de boli. De exemplu, sunt rezultate încurajatoare în cazul anemiei falciforme. Pentru editarea genomică a liniei germinale trebuie analizate foarte bine aspectele etice, e un subiect care mă interesează. Mă bucur că sunt inițiative internaționale pentru a crește transparența în jurul acestui subiect”
Jennifer Doudna: „Cas-9 este o proteină dinamică. Printr-o serie de experimente prin care am identificat mișcările de la diferite niveluri ale proteinei am caracterizat conformațiile posibile și cele relevante pentru interacțiunea cu ADN-ul”
12:36 Jennifer Doudna: „Acesta a fost un punct care a început ca o curiozitate și a ajuns un proiect care are un mare impact. Înțelegând sistemul care apare în mod normal la bacterii a fost posibil să îl simplificăm pentru a fi utilizat în mai multe moduri pentru a realiza clivări specifice la nivelul ADN”
12:33 Jennifer Doudna: „Colaborarea cu Emmanuelle a fost o oportunitate minunată pentru a răspunde la o întrebare esențială – Care e funcția proteinei CRISPR-Cas9? Această proteină specifică era importantă pentru o bacterie – Streptococcus pyogenes. Aceasta are o proteină CRISPR-Cas9 codificată pentru protecția față de infecția virală. Întrebarea era CUM?
12:29 A doua prezentare este susținută de Dr. Jennifer Doudna, profesor de biochimie, biofizică și biologie structurală la Universitatea Berkeley din California.
12:28 Emmanuelle Charpentier: „Munca nu ar fi fost posibilă fără tinerii cercetători. Munca din partea mea a început la Universitatea din Viena, ulterior am început cercetările în acest domeniu în Suedia. Mulțumesc familiei, prietenilor, colegilor care m-au sprijinit”
12:26 Emmanuelle Charpentier: „Cred că trebuie să studiem mai mult bacteriile și virusurile. Ultimii 15 ani au arătat în ce măsură aceste cercetări sunt utile pentru descoperirea de noi tehnologii, noi tratamente”
12:23 Emmanuelle Charpentier: „Ce urmează? Sunt identificate noi sisteme CRISPR-Cas. Recent, noi mecanisme de apărare au fost identificare în microorganisme. Probabil noi tehnologii vor fi identificate în viitor. Este un domeniu de interes pentru tinerii cercetătorii. Au un instrument foarte util, au un instrument genetic care nu exista acum 20 ani.
Impactul CRISPR-Cas are sens în contextul altor tehnologii (Secvențiere, screening, imagistică etc.). E un moment important pentru a studia evoluția și diversitatea lumii”
12:22 Emmanuelle Charpentier: „În ultimii 6 ani cercetătorii au perfecționat tehnologia, ceea ce permite aplicații fără precedent. Aceasta este eficientă să acționeze materialul genetic a unor tipuri variate de celule umane, animale sau vegetale. Este o tehnologie cu adevărat transformativă”
12:18 Emmanuelle Charpentier: „Tehnologia CRISPR-Cas9 permite mai multe tipuri de intervenție asupra ADN-ului, poate elimina o mutație, poate introduce noi mutații, pot fi șterse gene sau pot fi introduse noi secvențe într-o zona de interes”
12:04 Emmanuelle Charpentier – Instrumentele genetice de-a lungul timpului:
Anii 1970 – Tehnologia ADN-ului recombinant, secvențierea ADN-ului
Anii 1980 – Tehnica PCR
Anii 1990 – Țintirea genelor
Anii 2000 – Nucleazele zinc-finger și TALEN
Anul 2012 – Tehnica CRISPR-Cas9
12:02 Prima prezentare este susținută de Prof. Dr. Emmanuelle Marie Charpentier, director al Institutului de Biologia Infecțiilor Max Plank. Are o vastă experiență științifică internațională, trăind în cinci țări, șapte orașe și lucrând în 10 instituții diferite.
12 Octombrie 2020
Emmanuelle Charpentier și Jennifer Doudna sunt laureații Premiului Nobel pentru Chimie de anul acesta, pentru dezvoltarea metodei de editare genomică CRISPR/Cas9. Acest instrument permite modificarea de înaltă precizie a ADN-ului animalelor, plantelor și microorganismelor. La doar 8 ani de la publicarea primului articol care a demonstrat eficiența CRISPR-Cas9, tehnologia este utilizată de către cercetători din toată lumea, în domenii precum tratamentul bolilor ereditare și oncologice, creșterea rezistenței și productivității culturilor agricole sau reintroducerea unor specii dispărute.
„Premiul din acest an este despre rescrierea codului vieții”- Goran K. Hansson, Secretarul general al Academiei Regale Suedeze de Științe.
„Acest instrument genetic are o putere enormă, care poate avea un impact major asupra tuturor. Nu a transformat doar științele fundamentale, ci a stat și la baza unor inovații agricole și va duce la dezvoltarea de tratamente medicale revoluționare”, afirmă Claes Gustafsson, Șeful Comitetului Nobel pentru Chimie.

Cum a fost descoperită tehnica genomică CRISPR/Cas9
Prof. Dr. Emmanuelle Marie Charpentier este director al Institutului de Biologia Infecțiilor Max Plank. Are o vastă experiență științifică internațională, trăind în cinci țări, șapte orașe și lucrând în 10 instituții diferite. În anul 2002 începea să coordoneze propriul grup de studiu la Universitatea din Viena, concentrându-se asupra uneia dintre cele mai devastatoare bacterii: Streptococcus pyogenes. Aceasta poate determina atât infecții ușor tratabile precum amigdalită sau impetigo, cât și unele grave precum fasciita necrozantă, care pot duce la deces prin sepsis.

În paralel, Dr. Jennifer Doudna, profesor de biochimie, biofizică și biologie structurală la Universitatea Berkeley din California, devine interesată de CRISPR și genele asociate CRISPR, Cas. În anul 2006 avea deja 20 de ani experiență în domeniul ARN-ului. Intrase recent în noua arie de interes științific, cea a interferenței ARN: studierea rolului unor molecule mici de ARN în reglarea activității genelor în celulă.

(Sursă foto: UC Berkeley, Stephen McNally)
Un coleg microbiolog îi împărtășește o nouă descoperire: comparând material genetic de la bacterii foarte diferite au fost identificate secvențe ADN repetitive, surprinzător de bine conservate. Același cod genetic este repetat, dar între secvențele repetate există fragmente intercalate, unice, care diferă. Aceste structuri de secvențe repetate au fost numite CRISPR (clustered regularly interspaced short palindromic repeats). A fost observat apoi că secvențele unice, nonrepetitive din CRISPR se potrivesc cu codul genetic al multor virusuri. Astfel s-a dezvoltat ipoteza că sistemul CRISPR face parte dintr-un sistem imunitar antic, antiviral al genurilor Bacteriae și Archea. Dacă o bacterie supraviețuiește unei infecții virale, integrează o parte a codului genetic viral în propriul genom ca o memorie imună.
Prof. Doudna a început apoi să studieze mecanismul prin care acest sistem funcționează. După câțiva ani de cercetări, aceasta a descris clasa 1 a sistemului CRISPR/Cas. În paralel, alte grupuri de cercetare au descris clasa 2 a sistemului CRISPR/Cas. Aceste rezultate au arătat că sistemul imunitar al bacteriilor poate lua mai multe forme. Sistemul 1 are o funcționare mai complexă, care necesită mai multe proteine Cas pentru a dezarma un virus, în timp ce sistemul 2 este semnificativ mai simplu, necesitând mai puține proteine.
În acest timp, Prof. Charpentier, aflată din 2009 la Universitatea Umea din Suedia, colaborează cu o echipă din Berlin pentru a descrie rețeaua de sARN (small ARN) din S. pyogenes. Una dintre moleculele sARN abundent identificate are codul genetic foarte asemănător cu cel al secvențelor CRISPR din genomul bacterian. Analizând mai mult codul genetic, descoperă că o secvență a moleculei neidentificate sARN se potrivește perfect cu elementul repetitiv al CRISPR.
Următorul pas a fost descrierea funcționării sistemului CRISPR al S. pyogenes. Acesta aparține sistemului 2 și folosește o singură proteină din clasa Cas, denumită Cas9, pentru a „tăia” ADN-ul viral. Rolul moleculei sARN neidentificată, denumită trans-activating CRISPR RNA (tracrRNA), este de a activa secvența lungă ARN creată pe baza secvenței CRISPR. Charpentier publică rezultatele asupra tracrRNA în martie 2011.
Cele două cercetătoare lucrau independent până la momentul întâlnirii întâmplătoare la o cafenea din Puerto Rico cu ocazia unei conferințe. Piesele de puzzle descoperite de acestea au format un tablou complet: în apărarea antivirală a S. pyogenes, CRISPR-ARN identifică ADN-ul viral, iar Cas9 este foarfeca care taie acest ADN. Însă sistemul nu funcționează fără tracrARN.
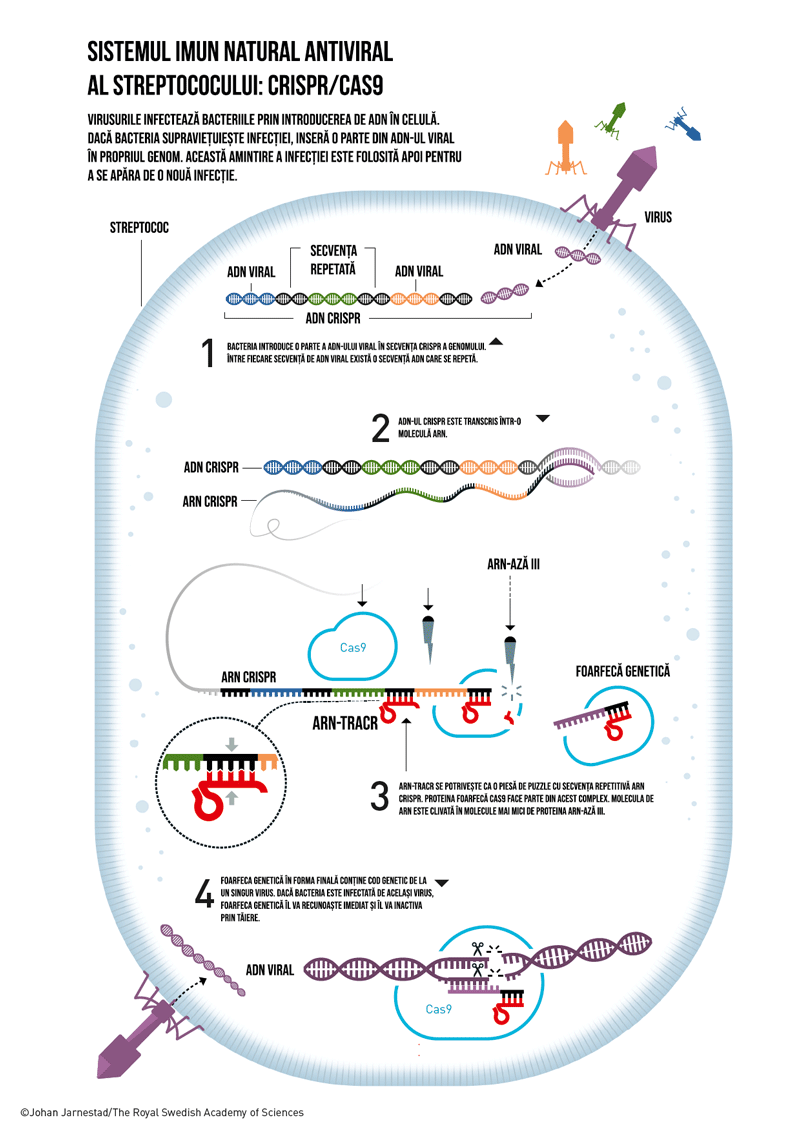
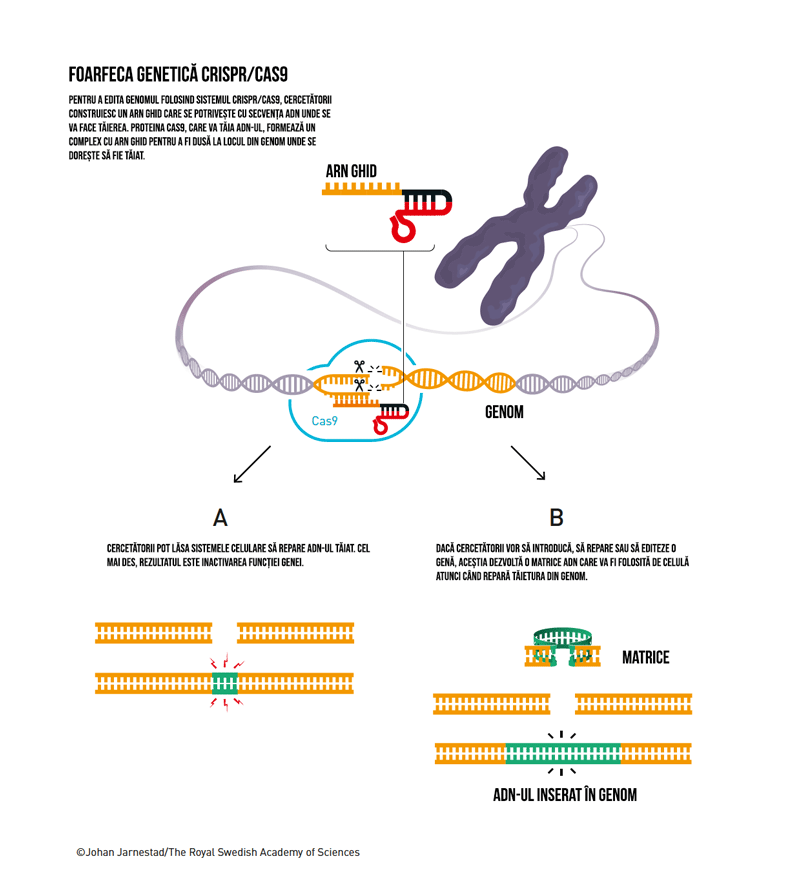
Povestea acestei descoperiri se putea opri aici, dar nu ar fi fost suficient pentru un Premiu Nobel. Charpentier și Doudna au continuat experimentele. Următorul pas a fost încercarea de a simplifica foarfeca genetică, combinând CRISPR-ARN și tracr-ARN într-o singură moleculă, denumită ARN de ghidaj (guide RNA).
Experimentul care a schimbat viitorul cercetărilor genetice a implicat modificarea secvenței CRISPR a foarfecei cu scopul a tăia o genă în 5 părți specifice. După publicarea succesului experimentului în 2012, au urmat multiple confirmări ale eficienței metodei de a modifica genomul celulelor animale, dar și a celulelor umane.

Cum a fost și va putea fi aplicată această tehnologie
Această metodă de editare genomică este mult mai rapidă și ușor de folosit comparativ cu cele utilizate anterior. Permite modificarea de precizie a genomului: inactivarea temporară sau permanentă a genelor, eliminarea unei gene mutante și introducerea unei noi gene sau chiar modificarea unei singure litere genetice.
„CRISPR-Cas poate aduce beneficii enorme umanității, dar desigur trebuie utilizată cu responsabilitate. De exemplu, eu și majoritatea colegilor mei refuzăm să facem intervenții asupra căi germinative umane, ceea ce ar influența genomul generațiilor următoare”- explica în 2017 Prof. Charpentier despre posibilitatea de abuzare a tehnologiei.
Cu toate acestea, He Jiankui este primul cercetător care a anunțat în 2018 folosirea tehnologiei pentru a crea primii embrioni umani modificați genetic (eliminarea genei CCR5 cu scopul de a obține imunitate HIV). Acest anunț a determinat un răspuns puternic din partea comunității științifice și a organizațiilor de reglementare.
Posibilitatea editărilor genomice care pot fi moștenite nu ridică doar considerații științifice și medicale, ci și etice, morale și sociale. O comisie internațională formată din experți în tehnologii de editare genomică, genetică și genomică umană, psihologie, medicină reproductivă, pediatrică și de adulți, ca răspuns al anunțului din 2018, a concluzionat următoarele:
„Editarea genomică ereditară nu este încă pregătită pentru a fi încercată în mod sigur și eficient la oameni. Utilizările clinice, dacă sunt permise, ar trebui să fie limitate la boli grave monogenice”.
Comunicarea și colaborarea internațională, atât între cercetători, cât și între organizațiile de reglementare, va putea permite continuarea dezvoltării tehnologiei cu minimizarea riscului de utilizare ilicită.
În 2020, a fost publicat primul studiu in vivo cu subiecți umani în care a fost utilizat CRISPR pentru tratamentul unei forme moștenite de orbire. Editarea genică în cazul distrofiilor retiniene are avantajul de a rămâne la nivel ocular și de a nu influența alte țesuturi sau organe.
CRISPR este folosită în studii și în lupta cu SARS-CoV-2: cercetătorii de la Universitatea Stanford, din California, au elaborat o strategie denumită PAC-MAN (Prophylactic Antiviral CRISPR in huMAN cells) pentru inhibiția virală. Această metodă poate degrada eficient ARN-ul provenit din secvențele SARS-CoV-2 și ale virusurilor vii influenza A la nivelul celulelor epiteliale pulmonare umane.
„Prin descoperirea lor, Emmanuelle Charpentier și Jennifer Doudna au dezvoltat un instrument chimic care a dus științele naturale într-o nouă epocă. Ne-au făcut să privim un nou orizont vast de potențial inimaginabil și pe drumul de explorare a acestui acestuia vom face cu siguranță noi și neașteptate descoperiri ,” concluzionează Comitetul Nobel.
Urmăriți emisiunea RaportuldeGardă LIVE, în care editorii Adriana Boată și Dr. Bianca Cucoș au discutat cu domnul Dr. Marius Geantă, președinte Centrul pentru Inovație în Medicină, despre descoperirea premiată anul acesta:
Citește și:
- Premiul Nobel pentru Fiziologie sau Medicină 2020: descoperirea virusului hepatitic C
- Utilizarea tehnologiei de editare genomică CRISPR în strategia pentru combaterea SARS-CoV-2 și a virusurilor gripale
- Tehnologia de editare genomică CRISPR, utilizată pentru prima oară in vivo la pacienți în tratamentul unei forme moștenite de orbire
- Premiul Nobel pentru Chimie 2020: dezvoltarea tehnologiei de editare genomică CRISPR-Cas9

