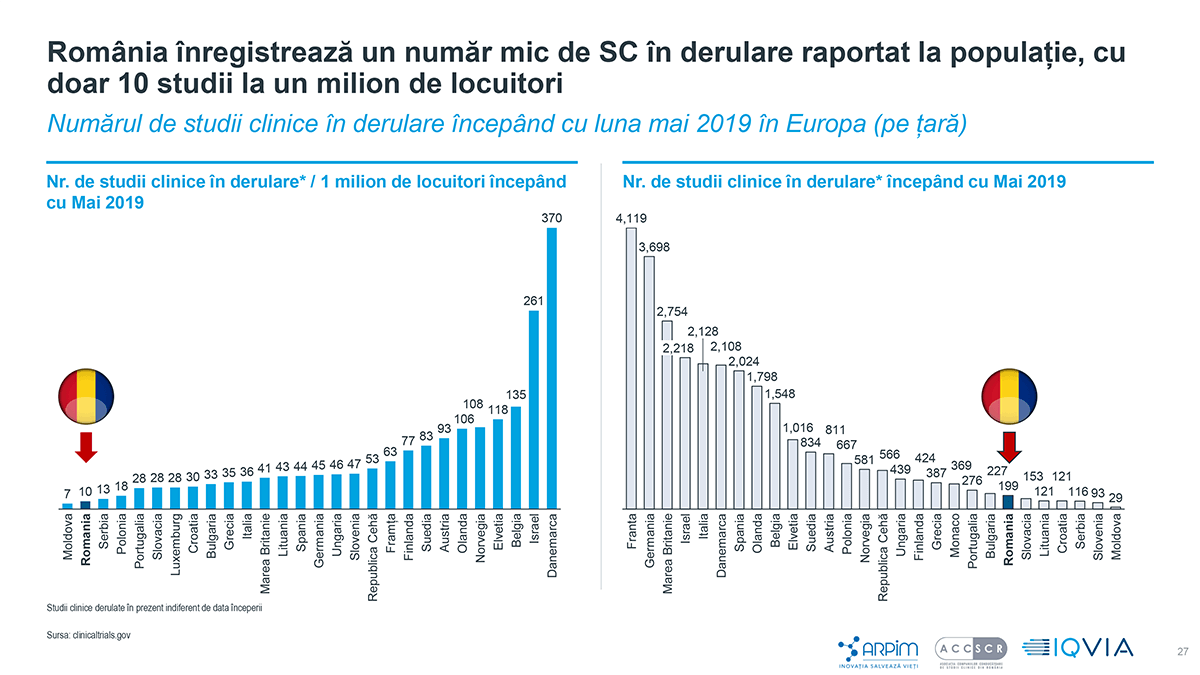
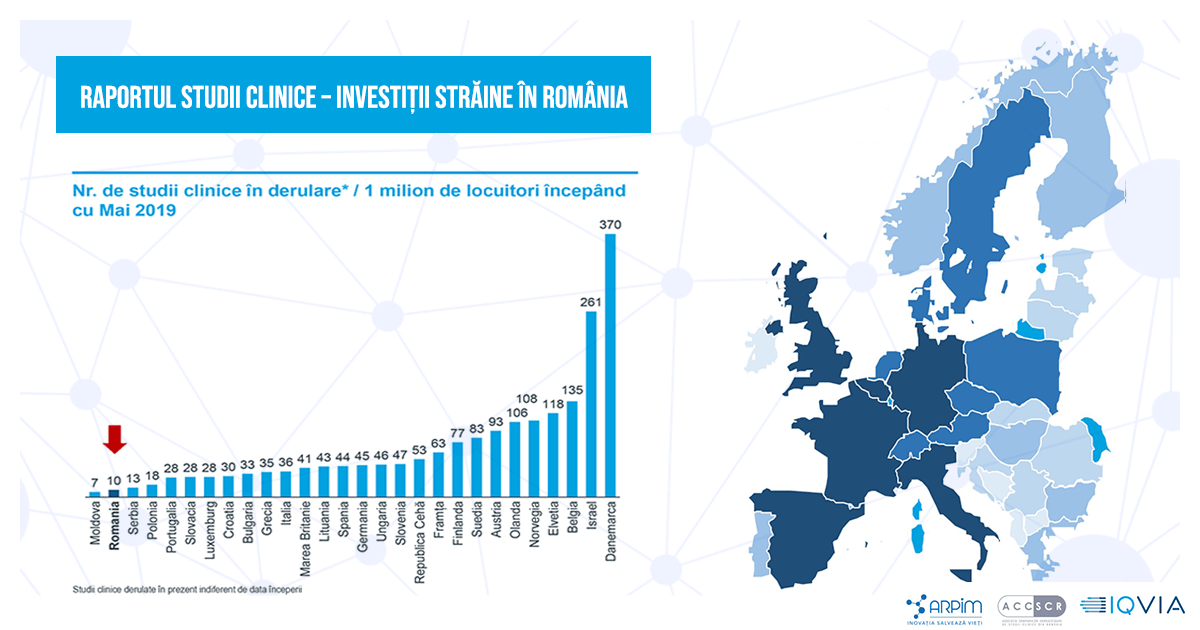
Raportul „Studii Clinice – investiții străine în România”: doar 10 studii clinice la 1 milion de locuitori se află în derulare începând cu mai 2019
Investițiile totale în studii clinice realizate de companii și sponsori au reprezentat contribuții la bugetul de stat de aproximativ 19,8 milioane de EUR în 2019. Acestea s-au tradus într-o economie minimă a Casei Naţionale de Asigurări de Sănătate (CNAS), generată de studiile clinice din 2019, de 5,3 mil EUR în cazul afecțiunilor oncologice și de 4,1 mil EUR în cazul afecțiunilor cardiovasculare.
Acestea sunt cifre din raportul Studii Clinice – investiții străine în România, realizat pentru Asociația Română a Producătorilor Internaționali de Medicamente (ARPIM) și Asociația Companiilor Coordonatoare de Studii Clinice în România (ACCSCR), care a fost lansat în cadrul unei dezbateri la care au participat reprezentanți ai pacienților, autorități, medici și reprezentanți ai companiilor farmaceutice și ai companiilor coordonatoare de studii clinice.
Conform comunicatului transmis, scăderea continuă a numărului de studii clinice derulate în România a constituit principalul motiv pentru care cele două asociații au solicitat IQVIA România un astfel de studiu.
„Studiile clinice sunt într-adevăr vitale, datorită beneficiilor pe trei mari paliere: avantajele pentru pacienți, care sunt incontestabile, avantajele pentru comunitatea medicală și pentru profesioniștii din Sănătate, care simt nevoia să fie actualizați cu toate descoperirile care apar, și, nu în ultimul rând, beneficiile pentru sistemul de sănătate. Pacienții români au dreptul fundamental la îngrijiri optime, de multe ori aceste noi medicamente reprezintă ultima lor șansă de supraviețuire. Pentru comunitatea medicală, studiile clinice înseamnă acces la tehnologie avansată. Pentru sistemul de sănătate, studiile clinice înseamnă degrevare de costuri, economii indirecte și permit reintegrarea pacienților în societate, deci forță de muncă sănătoasă”, a declarat în cadrul evenimentului Diana Loreta Păun, Consilier Prezidențial.
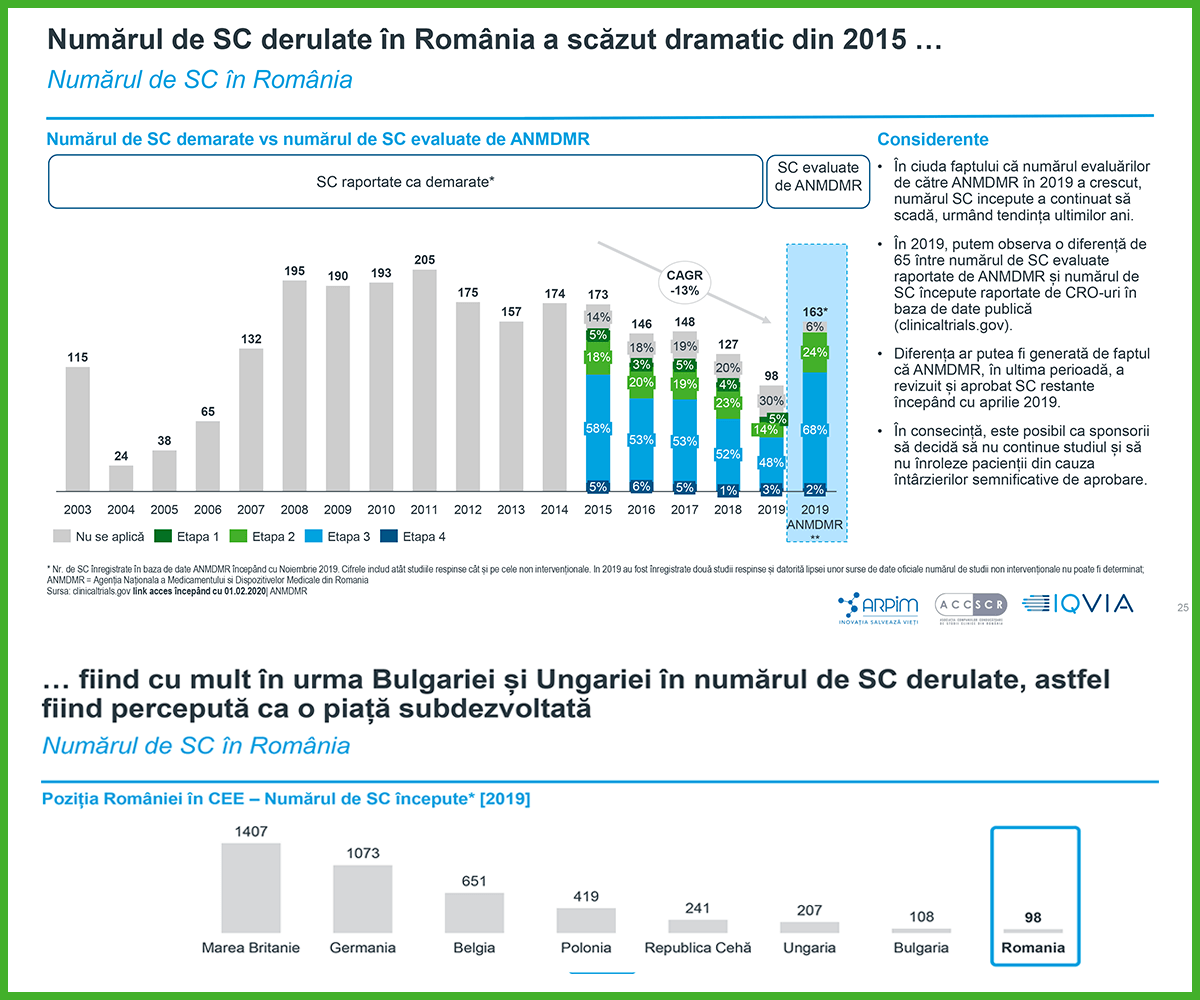
Deși este considerată o țară cu potențial pentru studii clinice, performanțele României în atragerea acestora înregistrează o tendință descendentă, numărul de studii scăzând drastic începând cu anul 2008. România (98 studii clinice) rămâne în urma țărilor mai mici, precum Bulgaria (108) și Ungaria (207), ca număr de studii clinice efectuate în 2019. Dacă numărul de studii clinice la un milion de oameni ar fi aliniat la nivel de țară cu cele mai performante țări din regiune, piața studiilor clinice din România, de doar 72 milioane EUR, ar putea avea potențialul de a atinge 802 milioane EUR și chiar 1,4 miliarde EUR prin comparație cu cele mai performante țări din UE.
Țările dezvoltate din Europa precum Franța, Marea Britanie și Germania domină piața cu mii de studii clinice începute în perioada 2015 – 2019, Franța înregistrând 10.000 de studii clinice începute în perioada menționată. În aceeași perioadă, în România au fost demarate 692 de studii clinice, țara noastră fiind în urma unor țări precum Polonia, Cehia, Ungaria, Bulgaria.
„E păcat că nu dezvoltăm acest domeniu, cel al studiilor clinice, pentru că, cel puțin la nivel teoretic și legislativ, există voința să dezvoltăm niște mecanisme proprii, când trebuie să luăm sau să fundamentăm niște decizii în acest domeniu: accesul accelerat pe piață a unor produse înregistrate în alte țări. Sper ca în viitorul apropiat să aducem modificările legislative care se impun în acest domeniu pentru a pune în practică procesul de debirocratizare. Un alt aspect trebuie discutat serios când vom lua în dezbatere modificarea legislației: responsabilitatea funcționarului”, László Attila, Președinte Comisia pentru Sănătate Publică, Senatul României.
Principalul investitor este sectorul farmaceutic, având cea mai ridicată rată de investiții în cercetare și dezvoltare (~164 miliarde EUR cheltuiți în 2018 la nivel global, cu o creștere continuă de 3-4% pe an).
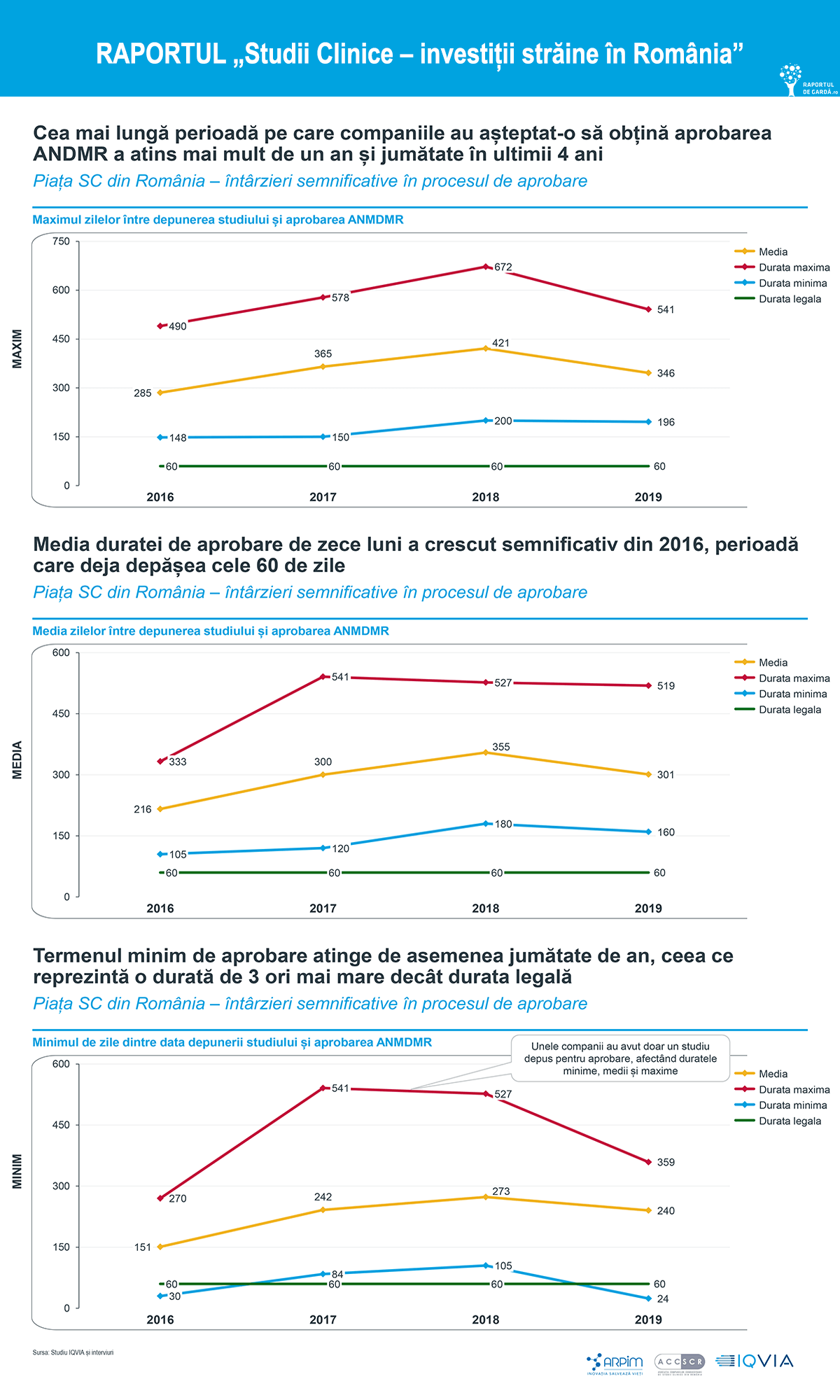
Întârzieri semnificative în procesul de aprobare
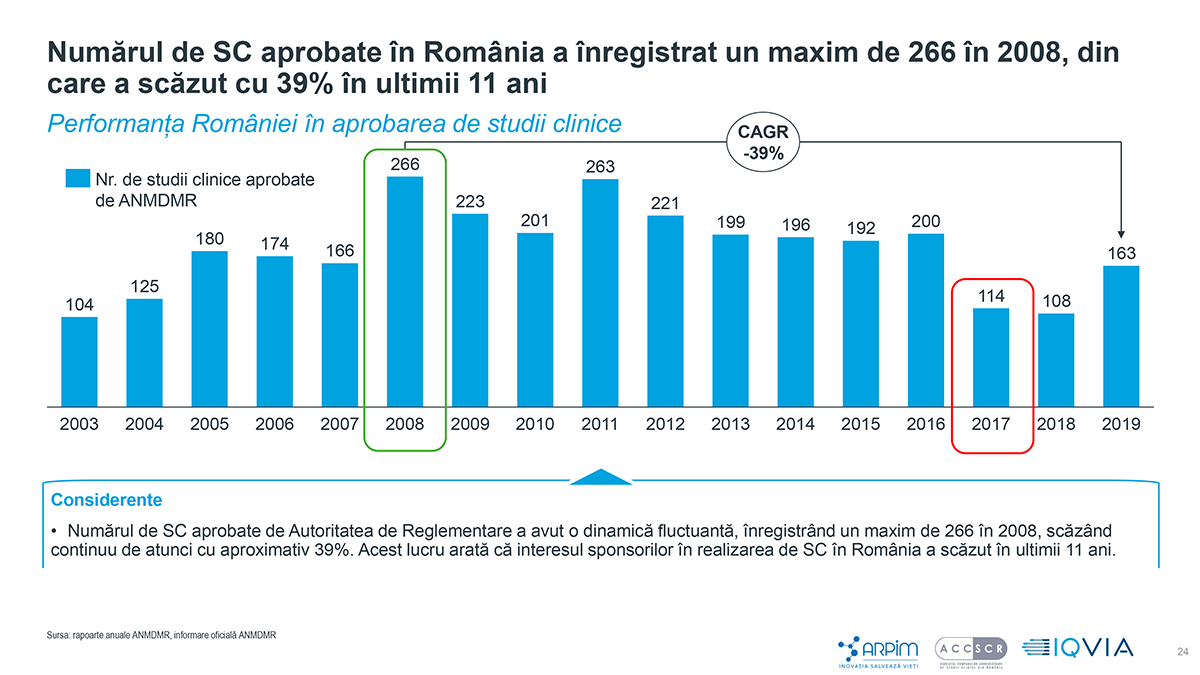
Numărul de studii clinice aprobate de Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România (ANMDMR) a ajuns la un maxim de 266 în 2008, înregistrând apoi scăderi majore în ultimii 11 ani (-39%). Cu 163 de studii aprobate în 2019 și cu doar 10 studii la un milion de locuitori, România înregistrează un număr mic de studii clinice în derulare, raportat la populație, doar Moldova fiind în urma noastră la nivel european, cu 7 studii la un milion de locuitori.
„Termenul de aprobare a studiilor clinice în această perioadă a fost de 7-10 zile și probabil va crește la 20 de zile în perioada următoare. Prin ceea ce face, Agenția a demonstrat că tratează cu prioritate studiile clinice pentru COVID-19. O îmbunătățire a situației actuale ar fi un Program Național de susținere a studiilor clinice, care să aibă acordul Guvernului și Parlamentului. Sunt țări care au implementat acest model, pentru că studiile clinice reprezintă un beneficiu și aș pune pe primul loc beneficiile pentru pacienți și accesul la tratamentele inovatoare. Prin măsurile care vor fi aprobate se va simplifica documentația și implicit timpul de aprobare”, a declarat Bujor Almășan, Președinte Agenția Națională a Medicamentului și a Dispozitivelor Medicale din România.
Tot în cadrul evenimentului la care au fost prezentate aceste date a existat și o sesiune de întrebări și răspunsuri. Una dintre întrebări a fost pentru domnul Bujor Almășan, din partea unei foste angajate ANMDM. Întrebarea a fost legată de câte studii clinice aprobă un evaluator din cadrul Agenției, în contextul în care, la nivelul UE, un evaluator aprobă între 4 și 8 studii săptămânal, conform datelor pe care aceasta le deținea. Redăm răspunsul domnului Almășan:
„Legat de faptul că sunt autorități care reușesc să aprobe între 4 și 8 studii – nu neg acest lucru. Nu am date concrete, dar ar trebui să știe că acele autorități au un număr mult mai mare de evaluatori decât are agenția. (…) La noi sunt 3 (studii) pe lună (aprobate)”.
Potrivit studiului, în cadrul căruia au fost intervievați și o serie de actori cheie din acest domeniu, asociațiile de pacienți consideră că întârzierile mari în procesul de aprobare reprezintă una dintre barierele în dezvoltarea pieței de studii clinice, cauzată de factori precum birocrația procesului de aprobare și reticența ANMDMR de a face reformele necesare pentru îmbunătățirea procesului de reglementare.
Alte probleme majore sunt reprezentate de lipsa de informare în rândul pacienților privind studiile clinice, lipsa de transparență a autorităților și lipsa de motivare a medicilor de a se angaja și a promova în rândul pacienților studiile clinice, din cauza resurselor de timp limitate, impredictibilității privind compensarea unor tratamente inovative în viitor și a întârzierilor de aprobare a studiilor clinice.
Beneficii pentru buget și pentru pacienți:
- 2.783 pacienți cu boli cardiovasculare sunt tratați prin studii clinice demarate în 2019, cu un cost mediu per pacient suportat de CNAS de 1.482 EUR. Aceste studii clinice aduc o economie la bugetul CNAS estimată la 4,1 milioane de euro;
- În cazul bolilor oncologice, 1.760 de pacienți sunt tratați în studii clinice demarate anul trecut, costul mediu per pacient fiind 3.021 EUR și aduce economii la buget de 5,3 milioane EUR;
- 6.561 pacienți sunt testați gratuit cu RMN/CT prin studii clinice, realizând o economie pentru buget de peste 341.000 EUR.
Conform comunicatului emis de ACCSCR, IQVIA și ARPIM, în medie, doar unul-doi din fiecare 15.000 de compuși chimici sintetizați în laboratoare vor trece cu succes etapele de dezvoltare necesare pentru a deveni un medicament care să ajungă la pacienți. Studiile clinice sunt necesare pentru a dezvolta medicamente și vaccinuri care salvează vieți și sunt cruciale în perioadele de pandemie. Deși nu există încă opțiuni terapeutice sau preventive pentru COVID-19, există numeroase studii în care investigațiile clinice ale medicamentelor noi și existente se află în creștere exponențială.
Principalele avantaje percepute ca urmare a desfășurării de studii clinice pentru economie și comunitate sunt:
- accesul la tratamente de înaltă calitate pentru pacienți;
- retenția personalului medical;
- contribuția la sistemul public de sănătate;
- accesul la investigaţii paraclinice de înaltă calitate pentru pacienți;
- educația și dezvoltarea profesională a cercetătorilor;
- contribuția la economie;
- transferul tehnologic și de cunoştinţe.
Soluții pentru o piață mai performantă
În urma studiului și a interviurilor cu actorii cheie din domeniu, au fost identificate 3 domenii principale pentru a dezvolta piața de studii clinice din România.
Primul dintre acestea vizează simplificarea procedurii de aprobare prin găsirea unor soluții pentru alocarea unor resurse corespunzătoare din partea ANMDMR pentru evaluarea studiilor clinice și îmbunătățirea procesului de aprobare prin implementarea unor reforme și prioritizări. Punerea în practică a legii 134/Aug 2019 de Reorganizare a ANMDMR ar fi de un real folos în acest sens.
Al doilea domeniu de îmbunătățit este creșterea informării publice printr-un acces mai bun al pacienților la informații (website dedicat, transparentizarea informațiilor din partea ANMDMR) și prin campanii de informare despre scopul și procesul unui studiu clinic. Cel de-al treilea domeniu vizează creșterea capacității site-urilor prin crearea unor unități dedicate pentru cercetarea clinică.
Andrei Baciu, secretar de stat Ministerul Sănătății a declarat în cadrul evenimentului:
„Momentul acestei discuții și prezentarea acestui studiu au un rol important. Datele prezentate sunt extrem de utile. Este o discuție importantă care trenează de câțiva ani. Trebuie să ajungem la standarde europene cât mai repede, însă este important să știm și de unde pornim.
Știm cu toții decalajul privind accesul la tratamente noi, de aceea studiile clinice reprezintă o alternativă reală pentru pacienți. Trebuie să acordăm corpului medical din România posibilitatea, prin susținerea acestui domeniu al cercetării.
Trebuie să folosim sursele de finanțare europene care se întrevăd pentru perioada 2021-2027 pentru care putem începe să planificăm încă din perioada următoare.
Din nefericire, acest domeniu, al studiilor clinice, nu a fost tratat cu maximă importanță în ultimii ani. Nu se pot schimba însă lucrurile peste noapte. Am încercat să accelerăm demersurile pentru a reduce diferențele între perioadă de așteptare din România și perioada de așteptare din alte țări. S-au identificat două soluții preliminare: prima este legată de schimbarea conformației în ceea ce privește accesibilitatea studiilor clinice, la care s-a lucrat în ultimele săptămâni, a doua măsură este cea a creșterii resursei umane care gestionează acest sector.
Vă asigur de toată disponibilitate Ministerului Sănătății de a accelera cât de mult posibil acest subiect al studiilor clinice”.
Urmăriți dezbaterea transmisă LIVE pe pagina de Facebook ARPIM.
Citește și:
- Raportul IQVIA „Evaluarea inovațiilor terapeutice centrate pe pacient”. ARPIM face apel pentru includerea experienței pacientului în procesul de evaluare a tehnologiilor medicale
- Simpozionul studii clinice 2019: cum accelerăm accesul la terapii moderne
- Studiu IQVIA: „Accesul pacienților români la medicamente inovatoare”

