STUDIU: Larotrectinib, eficient în 17 tipuri de cancer în care este evidențiată fuziunea TRK. Se deschide era medicamentelor “tumor-agnostic” în terapia cancerului
Tratarea cancerului după profilul molecular și nu după localizarea tumorii este unul dintre marile obiective ale medicinei de precizie. Larotrectinib este un medicament experimental care îndeplinește acest obiectiv fiind unul dintre așa numitele terapii de tip „tumor – agnostic” și prima terapie orală din această categorie. Despre noua substanță s-a spus în cadrul Întâlnirii Anuale a Societății Americane de Oncologie Clinică din iunie, 2017, că este „visul oricărui om de știință devenit realitate” și că „îndeplinește promisiunea medicinei de precizie”.
Larotrectinib are ca țintă tumorile care exprimă fuziunea TRK și trei studii au evidențiat rezultate fără precedent, medicamentul având rate de răspuns mari pentru toate cele 17 tipuri de cancer care pentru care a fost testat, atât în populații de adulți cât și de copii. Cele mai noi date au fost publicate recent în New England Journal of Medicine, după încă 3 luni de urmărire a celor 55 de pacienți incluși în cele 3 studii.
„Datele evidențiate în NEJM arată potențialul pe care medicamentul îl are pentru bolnavii de cancer care prezintă fuziunea TRK. Aceste date GARANTEAZĂ pentru SCREENINGUL pacienților de toate vârstele cu tumori solide avansate” – Dr. David Hyman, investigatorul principal al studiului NAVIGATE

Ce știm până acum despre larotrectinib
- Larotectinib a demonstrat activitate anti-tumorală în cancerele care prezintă fuziunea TRK, indiferent de vârsta pacientului sau de tipul tumorii
- S-a identificat o rată generală de răspuns de 75% în cancerele ce prezintă acest tip de mutație în populații de adulți și copii
- 86% dintre pacienții care au răspuns la tratament au continuat cu larotrectinib sau au fost supuși intervențiilor chirurgicale cu intenție curativă
- La un an, 71% dintre răspunsurile terapeutice erau susținute
- Larotrectinib este SINGURUL inhibitor pan-TRK selectiv, este considerat PRIMUL folosit într-adevăr într-o manieră „tumor-agnostic”, este PRIMA terapie „tumor-agnostic” orală și este PRIMA terapie dezvoltată simultan pentru adulți și copii.
Cum funcționează larotrectinib
Familia receptorilor TRK (tromomyosin receptor kinase) cuprinde 3 proteine transmembranare TrkA, TrkB și TrkC care sunt codificate de genele NTRK1, NTRK2, NTRK3. Acești receptori tirozin-kinazici sunt exprimați în țesutul neuronal și au un rol important în funcționarea sistemului nervos prin intermediul neurotrofinelor, substanțe care contribuie la dezvoltarea neuronală.
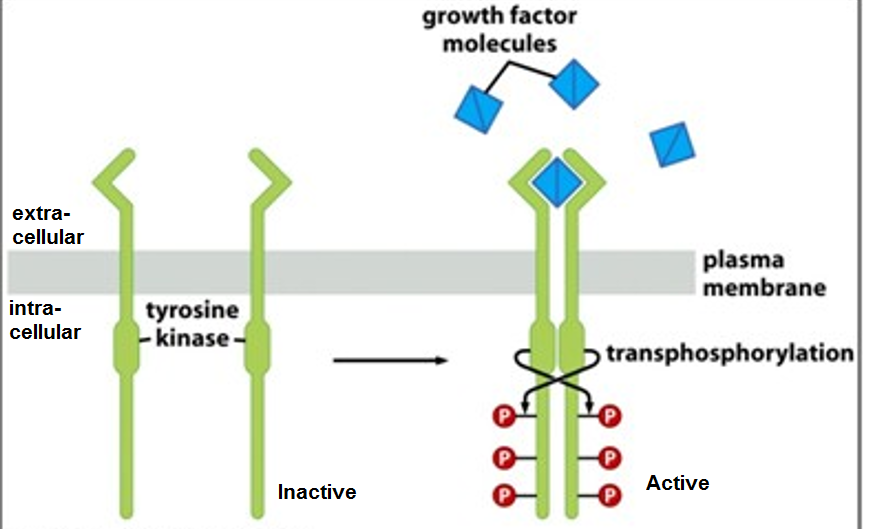
Larotrectinib este un medicament experimental cu indicații în tratamentul multiplelor tipuri de cancere care prezintă mutații la nivelul TRK. Din ce în ce mai multe date arată că genele NTRK pot fuziona într-un mod haotic cu alte gene, ceea ce va determina o amplificare a semnalelor de creștere activate prin TRK caree pot favoriza carcinogeneza în mai multe zone din organism.
Aceste mutații genetice determină o semnalizare aberantă pe calea TRK și determină creșterea tumorală. Larotrectinib țintește direct TRK, blocând aceste semnale activatoare caree permit cancerelor ce exprimă fuziunea TRK să prolifereze.
„Noul medicament ne duce într-o nouă eră, în care tratamentul se bazează într-adevăr pe o mutație, nu pe localizarea cancerului” – Dr. Sumanta Kumar Pal, expert ASCO
Larotrectinib a primit statut de terapie inovatoare, statut de medicament orfan și indicație pentru boli pediatrice rare din partea FDA.
Ce spun studiile despre larotrectinib?
În 2013, era prezentată fuziunea genelor TRK în revista Nature Medicine ca mutație driver care influențează carcinogeneza la pacienții cu carcinom pulmonar non-microcelular. Cinci ani mai tarziu, apar în New England Journal of Medicine rezultatele a trei studii de fază I, II ce evaluează pacienții cu neoplasme în stadiu avansat ce prezintă acestă anomalie genetică.
55 de pacienți cu vârste cuprinse între 4 luni și 76 de ani, însumând 17 tipuri de cancere, ce prezentau fuziunea TRK, au fost tratați cu larotrectinib. Toți pacienții (12 copii și 13 adulți) au avut forme local avansate sau metastatice de: cancer de colon, pulmonar, pancreatic, tiroidian, salivar, gastrointerstinal precum și melanom și sarcom.
Prin trei studii clinice s-au analizat fuziunile genelor TRK la pacienții ale căror neoplasme au progresat după tratamentul standard
- un studiu de fază I la care au participat adulți
- un studiu de fază I/II în care au fost înrolați copii (SCOUT)
- un studiu de fază II ce a inclus adulți și adolescenți (NAVIGATE)
Rata generală de răspuns a fost de 75% (44 din 55 de pacienți). După o urmărire de 9,4 luni, 86% dintre pacienții care au răspuns la terapie (38 din 44 de pacienți) au continuat tratamentul sau au fost supuși intervenției chirurgicale cu viză curativă. Primul pacient tratat are încă un răspuns susținut și este în continuare pe terapie după 27 de luni.
Printre datele publicate în NEJM se numără și mecanismele detaliate ale rezistenței dobândite la larotrectinib. La 10 pacienți, boala a progresat în timpul tratamentului după ce boala fusese stabilă timp de 6 luni. 80% dintre aceștia au continuat tratamentul datorită beneficiilor clinice susținute.
Principalele reacții adverse au inclus creșterea nivelului transaminazelor, amețeli, neutropenie. Niciun pacient nu a întrerupt tratamentul din cauza efectelor adverse. Durata medie de răspuns și supraviețuirea fără progresie a bolii încă nu au fost atinse.
„Aceste studii demonstrează trecerea de la definirea cancerelor pe baza localzării la definirea lor prin prisma modificărilor moleculare care le determină creșterea. În ceea ce privește tratamentul, studiile arată că de acum putem în loc să definim bolile drept – cancer pulmonar sau colorectal sau alt tip de cancer cu o localizare specifică – să le definim drept cancere ce prezintă fuziunea TRK și să le tratatăm în funcție de acest driver.” – Dr. Robert C. Doebele, Universitatea din Colorado
Larotrectinib – o premieră?
Tratarea cancerului în funcție de anumite criterii molculare și nu în funcție de locul de origine este una dintre marile provocări ale momentului. Larotrecnitib nu este prima terapie de tip „tumor –agnostic”. De-a lungul timpului s-au făcut mai multe încercări de a dezvolta o terapie care să se potrivească pentru cât mai multe tipuri de cancer în funcție de anumiți biomarkeri, însă rezultatele nu au fost mereu conform așteptărilor. Inhibitorii BRAF de exemplu, funcționează doar pentru cazurile de melanom și în cazul cancerului tiroidian, dar nu și în cancerele colorectale.
Cu toate acestea, prima terapie aprobată de FDA pentru un defect genetic, nu pentru un tip tumoral este pembrolizumab. Deși atât pembrolizumab cât și larotrectinib reprezintă terapii de tip „tumor agnostic” există anumite diferențe. Pembrolizumab este o imunoterapie și se administrează intravenos, iar larotrectinib este o terapie țintită administrată oral. Dr. Hyman a explicat că este mai important ca niciodată să testăm pacienții pentru a vedea cine prezintă modificări genetice și poate beneficia de aceste tratamente.
Din anumite puncte de vedere, larotrectinib este un medicamente deschizător de drumuri. În prezent este singurul inhibitor pan-TRK selectiv și este posibil, conform estimărilor Dr. Hyman, să fie PRIMUL folosit într-adevăr într-o manieră „tumor-agnostic”. Acesta a mai declarat în cadrul ASCO 2017 că este foarte dificil să se găsească o altă terapie țintită care și pentru o singură afecțiune să aibă astfel de rezultate. De asemenea, este prima terapie dezvoltată simultan pentru adulți și copii.
„Fuziunile de la nivelul genelor NTRK, care pot fi identificate prin secvențiere genetică, sunt rare dar apar în anumite cancere la copii și adulți. Ne dorim să lucrăm cu autoritățile și cu comunitatea științifică pentru a face disponibil acest tratament pacienților cât de curând posibil” – Scott Fields, Șeful Departamentului de Oncologie de la Bayer.
Loxo Oncology, una dintre companiile implicate în dezvoltarea medicamentului a depus la FDA cererea de înregistrare a unui medicament nou – New Drug Application (NDA) pe baza datelor publicate și în NEJM. Urmează ca Bayer să depună anul acesta cererea de autorizație de punere pe piață în Uniunea Europeană.
Este necesar screening-ul pentru fuziunea TRK?
Se estimează că anual până la 5.000 de pacienți dezvoltă fuziunea TRK, însă numărul este subestimat deoarece există un deficit pe partea de diagnosticare. Primele fuziuni TRK au fost descoperite pentru cancerul de colon în 1982, iar în prezent s-au identificat peste 50 de gene diferite care fuziunează cu NTRK 1, 2 și 3.
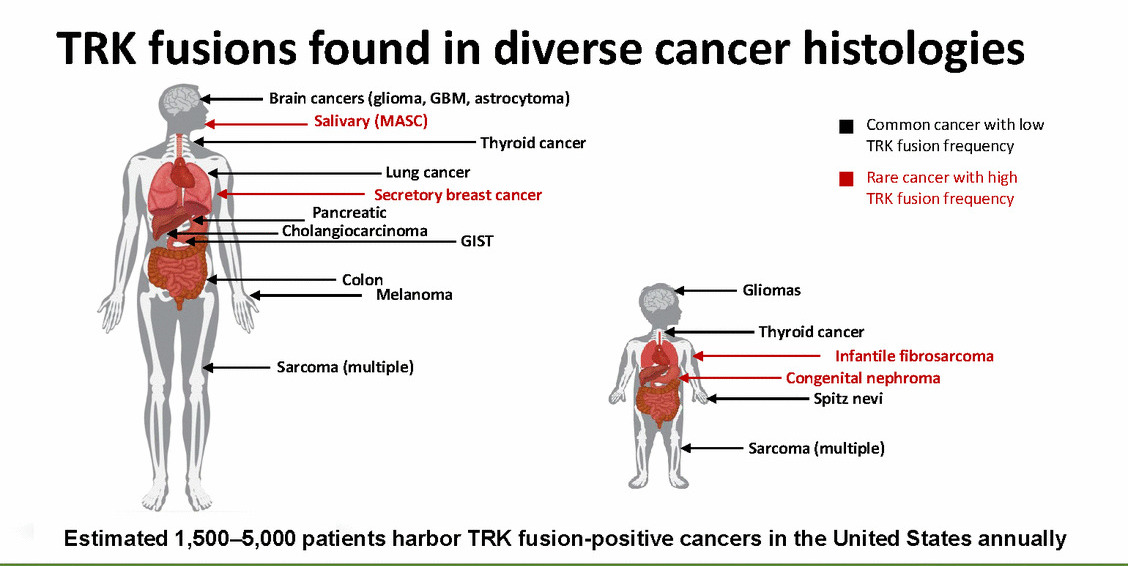
Fuziunile TRK se întâlnesc în 0,5 – 1% dintre cele mai frecvente tipuri de cancer – colon, pulmonar, mamar, tiroidian și melanom. În ceea ce privește cancerele rare, însă, mutația apare în peste 90% din cazuri – cancere de glande salivare, o formă de cancer de sân juvenilă și fibrosarcomul infantil. Aceste mutații pot fi identificate prin teste de secvențiere genetică de nouă generație cum sunt FoundationOne și Oncomine. Pentru ca pacienții cu aceste tipuri de mutații să fie tratați corespunzător, este necesar să fie și testați după noi standarde. Datele obținute din studii precum cele privitoare la larotrectinib susțin necesitatea testării genetice în masă pentru a se putea realiza cu adevărat ceea ce se numește medicina de precizie.
Articole similare:
- ANALIZĂ. 2.004 imunoterapii se află în dezvoltare, în 3.024 de studii clinice pentru 303 tipuri de cancer
- 5 inovații care vor schimba pentru totdeauna tratamentul cancerului, folosind sistemul imun al organismului
- #ASCO2017: Larotrectinib – singurul tratament selectiv împotriva fuziunii TRK

