Terapiile CAR-T, eficiente și în cazul tumorilor solide: primele rezultate pozitive în studii de faza I
Terapiile CAR-T dezvoltate împotriva antigenului CD19 au oferit rezultate fără precedent la pacienții cu neoplasme hematologice, care anterior aveau un prognostic sumbru. Astăzi, la acești pacienți se înregistrează rate de răspuns de peste 80%. În 2017, FDA a aprobat două terapii celulare Kymriah și Yescarta, iar un an mai târziu terapiile devin disponibile și în Europa. Cu toate acestea, marea provocare din ultimul deceniu în ceea ce privește terapiile CAR-T a fost extinderea utilizării acestora în tumorile solide.

Cu ocazia Întâlnirii Anuale a Asociației Americane pentru Cercetarea Cancerului (AACR – American Association of Cancer Research) s-au prezentat două studii de fază I care atestă eficacitatea terapiei CAR-T pentru tumori solide precum sarcoamele HER2 pozitive și mezoteliomul malign.
Combinația dintre terapia CAR-T și inhibitorii punctelor de control oferă rate de răspuns de peste 70% la pacienții cu mezoteliom malign și alte tumori solide
O echipă de cercetători de la Memorial Sloan Kettering Cancer Center (MSKCC) a evaluat terapia CAR-T îndreptată împotriva mezotelinei, o proteină frecvent exprimată la suprafața celulelor canceroase în mai multe tipuri de neoplasme, precum mezoteliomul malign dar și formele metastatice de cancer pulmonar și mamar.
Dr. Prasad S. Adusumilli, autorul principal al studiului, a declarat pentru Medscape că aceasta este „prima poveste de succes în ceea ce privește utilizarea terapiilor CAR-T pentru tumori solide”. Acesta a adăugat:
„Noutatea studiului nostru este că terapia CAR-T țintește o proteină de la suprafața celulelor canceroase – mezotelina, iar această terapie este administrată direct la nivel tumoral. Dacă abordarea va avea rezultate pozitive, 2 milioane de pacienți cu tumori solide care exprimă această proteină ar fi eligibili în SUA în fiecare an”
Au fost incluși în studiu 21 de pacienți dintre care 19 au fost diagnosticați cu mezoteliom pleural malign, iar celelalte două cazuri prezentau cancer mamar metastatic și cancer pulmonar. 40% dintre pacienți au primit cel puțin 3 linii de tratament anterior.
Celulele T au fost injectate direct în cavitatea pleurală prin intermediul unei proceduri de radiologie intervențională, după ce s-a realizat precondiționarea cu ciclofosfamidă. Toxicitățile au fost evaluate prin determinarea valorilor troponinei și prin evaluări imagistice CT, PET și ecografie.
- După o perioadă de 38 de săptămâni s-a observat că celulele T au persistat în sângele periferic în cazul a 13 dintre pacienți
- Prezența celulelor T s-a corelat cu o reducere de peste 50% a valorilor mezotelinei (mesothelin-related peptide) în sânge și cu regresia tumorilor la evaluarea imagistică
- Pentru subgrupul de pacienți care au primit terapie CAR-T, ciclofosfamidă și cel puțin 3 doze de imunoterapie cu inhibitori ai punctelor de control, rata de răspuns a fost de 72%
Un pacient cu mezoteliom a fost supus unei intervenții chirurgicale cu intenție curativă, urmată de radioterapie. La 20 de luni de la diagnostic pacientul supraviețuiește și nu mai necesită tratament.
În studii preclinice s-a observat o scădere a eficienței terapiilor CAR-T în cazul tumorilor solide voluminoase. Inhibitorii punctelor de control au fost sugerați ca soluție având în vedere faptul că pe modele animale, tratamentul cu inhibitori PD-1 a dovedit capacitatea de reactivare a celulelor CAR-T și eradicarea tumorilor. Pe baza acestor studii, 15 pacienți au primit inhibitori PD-1, după ce s-a observat că nu au existat toxicități asociate terapiei CAR-T.
„Studiul susține strategia de administrare a terapiei CAR-T combinată cu inhibitori PD-1. În acest mod putem transforma tumorile solide reci în tumori calde prin infuzia celulelor T și să le menținem astfel prin administrarea inhibitorilor punctelor de control” – Dr. Adusumili
Rezultatele terapiei combinate au arătat:
- După 21 de cicluri de tratament cu inhibitori ai punctelor de control doi pacienți au avut răspuns metabolic complet la evaluarea PET, la 32 și 60 de săptămâni, iar răspunsurile se mențin în timp
- 5 pacienți au prezentat răspunsuri parțiale, iar 4 boală stabilă
„Combinarea mai multor strategii – radiologie intervențională, celule T modificate genetic și noile imunoterapii – a determinat rezultate încurajatoare și oferă argumente pentru a cerceta mai departe această abordare în cancere agresive, rezistente la tratament, precum mezoteliomul, cazuri în care nu avem în prezent o terapie optimă” – Dr. Prasad Adusumili
Experții MSKCC menționează abordările inovatoare ale acestui studiu:
- IcasM28z – „butonul de siguranță” pentru terapia CAR-T
Pentru a îmbunătăți profilul de siguranță al terapiilor CAR-T se apelează la molecule speciale care funcționează ca un „buton de siguranță”. Anumite gene (suicide genes) exprimate alături de cele ale receptorului CAR pot induce moartea celulară dacă sunt activate de o anumită substanță. iC9 (inducible caspase 9) este o enzimă care funcționează după acest principiu. Acest „buton de siguranță” poate fi exprimat la nivelul celulelor T fără a avea o influență asupra funcției sau specificității pentru antigen. IcasM28z a fost mecanismul pro-apoptotic folosit în cazul terapiei celulare din studiul de fază I realizat de MSKCC. În cazul în care apare o toxicitate legată de terapie se administrează intravenos o substanță care poate distruge celulele CAR-T.
- Administrarea terapiei direct în cavitatea pleurală
S-a observat că atunci când celulele CAR-T sunt injectate în sânge se mențin la nivel pulmonar 4-5 zile înainte să ajungă la locul tumorii iar concentrația este mică. Prin administrarea directă în cavitatea pleurală, celulele CAR-T se multiplică în milioane de copii și persistă.
- Combinarea cu inhibitorii punctelor de control
Cele mai bune rezultate s-au obținut la pacienții care au primit tratament cu inhibitori ai punctelor de control după infuzia regională a terapiei CAR-T.
„Ceea ce este interesant în acest studiu este faptul că se propune o strategie multimodală pentru a pătrunde la nivelul tumorilor solide. Abordarea multimodală care include imunoterapia este o cale creativă de a combate supresia imună a micromediului tumoral” – Dr. Prasad S. Adusumilli
Terapia CAR-T – eficientă alături de chimioterapie pentru sarcoamele HER2 pozitive
HER2 (human epidermal growth factor 2) este un alt marker tumoral care a fost utilizat drept țintă pentru dezvoltarea unei terapii CAR-T. 40% dintre osteosarcoame sunt HER 2 pozitive, însă spre deosebire de cancerul de sân, opțiunile terapeutice sunt reduse, iar chimioterapia oferă rezultate slabe. Dr. Shoba Navai, medic pediatru la Baylor College of Medicine, Texas Children’s Hospital a prezentat un studiu de fază 1 în cadrul Întâlnirii Anuale AACR.
Studiul a inclus 10 pacienți cu vârste între 4 și 54 de ani cu o formă de sarcom metastatic HER2 pozitiv care au primit cel puțin 5 terapii anterioare. Dintre aceștia, 5 pacienți erau diagnosticați cu osteosarcom, 3 cazuri de rabdomiosarcom și câte un caz cu sarcom Ewing și sarcom sinovial. S-a administrat terapia CAR-T combinată cu chimioterapie.
- Celulele CAR-T s-au multiplicat la 8 pacienți și au fost detectate la toți pacienții la 6 săptămâni după infuzie
- Un caz pediatric, diagnosticat cu rabdomiosarcom și metastaze osoase a prezentat răspuns complet timp de 12 luni însă a recidivat ulterior. S-a încercat o nouă administrare a terapiei CAR-T iar răspunsul complet s-a menținut încă 7 luni
- Un alt pacient cu osteosarcom și metastaze pulmonare prezintă răspuns complet timp de 32 de luni
- Trei pacienți prezintă boală stabilă iar în 5 cazuri boala progresează
- Profilul de siguranță este pozitiv, nu s-au detectat toxicități pulmonare
„Date din cercetări de laborator anterioare arată că terapia celulară anti HER2 este eficientă chiar și în cazul tumorilor care exprimă niveluri scăzute HER2, spre deosebire de trastuzumab. Studiul nostru demonstrează că terapia CAR-T anti HER-2 împreună cu chimioterapia are un profil bun de siguranță și cu toate că sunt necesare evaluări pe termen lung, terapia este asociată cu rezultate promițătoare la pacienți cu sarcoame avansate HER2+” – Dr. Shoba Navai
Provocările dezvoltării unei terapii CAR-T pentru tumori solide
- Care este ținta?
O diferență semnificativă între tumorile solide și neoplasmele hematologice este provocarea identificării antigenelor potrivite. Neoplasmele solide sunt heterogene.
Majoritatea antigenelor care ar putea fi folosite drept ținte se află intracelular iar doar 1% dintre proteinele celulare sunt exprimate la suprafața celulelor neoplazice. Terapiile CAR-T nu pot interacționa cu antigene intracelulare.
Dacă în leucemia limfocitară cronică sau în leucemia limfoblastica acută celulele tumorale exprimă la nivelul limfocitelor B molecula CD19, în cazul tumorilor solide variabilitatea antigenelor exprimate este mult mai mare. Aceste tumori nu exprimă un antigen specific ci se poate discuta mai frecvent despre antigen asociat unui anumit tip tumoral ( tumor associated antigen). Această lipsă a specificității crește riscul de efecte off-target. Chiar și niveluri scăzute ale expresiei anumitor antigene în țesutul normal se poate asocia cu toxicități fatale.
În prezent, peste 30 de antigene asociate tumorilor solide sunt evaluate în studii care vizează terapiile celulare CAR-T. Acestea includ neoantigene ( molecule exprimate doar la nivelul celulelor tumorale, care apar în urma unor mutații genetice) sau antigene tumorale selective care sunt elemente supraexprimate de celule neoplazice dar apar și în țesuturile normale ( precum mezotelina).
- Cum pătrund celulele T modificate genetic la nivel tumoral?
Chiar dacă se pot identifica antigene specifice următoarea problemă este reprezentată de barierele pe care trebuie să le depășească celulele CAR-T pentru a pătrunde la nivel tumoral. Expresia insuficientă a moleculelor de adeziune atât la nivelul celulelor T cât și la nivelul endoteliului celulelor tumorale sau variabilitatea chemokinelor secretate de tumoră limitează eficacitatea terapiei celulare care nu poate atinge o concentrație optimă. De aceea, sunt studiate mai multe căi de administrare regională a terapiilor CAR-T.
- Cum supraviețuiesc celulele CAR-T în micromediul tumoral?
Pe de o parte, există o serie de bariere fizice care limitează supraviețuirea celulelor T, precum caracteristicile stromei tumorale, numărul fibroblaștilor, etc. De asemenea, metabolismul celulelor neoplazice determină anumite modificări ale micromediului din jurul tumorii – hipoxie, aciditate, cantitate mică de nutrienți și stres oxidativ. Pe lângă acestea, activitatea limfocitelor T este inhibată de factori solubili imunosupresivi secretați de tumoră.
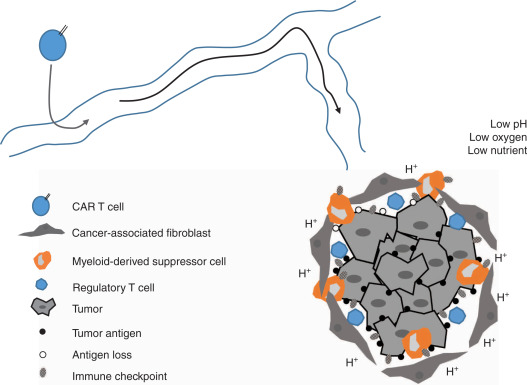
Pentru a depăși această „epuizare” a limfocitelor T s-au utilizat scheme terapeutice combinate cu inhibitorii punctelor de control. Agenții anti PD-L1, anti PD-1, și anti CTLA-4 au dovedit eficacitatea în combinație cu terapiile CAR-T.
Tumorile solide sunt caracterizate de o mare eterorgenitate iar studiile de până acum arată că prin adăugarea unei alte strategii precum inhibitorii punctelor de control sau chimioterapia se poate amplifica eficacitatea terapiilor celulare CAR-T, cu un profil bun de siguranță. Desigur, studii pe termen lung sunt necesare în continuare precum și identificarea de noi biomarkeri care pot prezice dacă pacienților li se potrivește monoterapia sau anumite combinații terapeutice.
CITEȘTE și:
- BREAKING NEWS. Kymriah, prima terapie celulară CAR-T aprobată în UE. Începe o nouă eră în tratamentul cancerului
- Cum definim terapia celulară CAR-T?
- Terapiile CAR T: Programarea propriilor celule T pentru a lupta împotriva cancerului – cum funcționează și care sunt provocările

