Un nou tip de terapie celulară CAR-T in vivo, bazată pe ARNm, ar putea reduce formarea fibrozei miocardice
Terapiile CAR-T ar putea fi generate direct în organism, fără a fi nevoie de prelevarea de limfocite și re-administrarea lor. Un studiu preclinic, publicat pe 6 ianuarie în Science, demonstrează potențialul unui nou concept de terapie CAR-T, in vivo, care poate ținti celulele de la nivelul cardiac implicate în dezvoltarea fibrozei. Spre deosebire de terapia CAR-T clasică, efectul terapiei in vivo este tranzitor și ar putea permite administrări multiple.
Terapia CAR-T in vivo evaluată în acest studiu presupune administrarea unei molecule de ARNm care ajunge la nivelul limfocitelor T și induce direct în organism producerea de receptori CAR, specifici pentru un antigen de la suprafața fibroblastelor activate, FAP (fibroblast activating protein). Unul dintre autorii studiului este chiar Drew Weissman, cel care a contribuit la dezvoltarea tehnologiei ARNm folosită pentru vaccinurile COVID-19.
Terapiile celulare CAR-T sunt considerate cel mai înalt grad posibil de personalizare al unui tratament, implicând modificarea celulelor imune ale pacientului (limfocitele T sunt cele mai studiate, dar sunt explorate și alte tipuri de celule) și reintroducerea lor în organism, demonstrând până în prezent cele mai importante progrese în oncologie. Prin CAR (chimeric antigen receptor) sunt desemnați receptori obținuți prin biotehnologie care permit limfocitelor T să recunoască antigene țintă (proteine de pe suprafața celulelor tumorale) și să dezvolte un răspuns imun specific față de acestea. Celulele T care exprimă acești receptori permit țintirea celulelor maligne și funcționează ca un medicament „viu”, asigurând memorie antitumorală pe termen lung.
Pentru exprimarea receptorului himeric (CAR) e nevoie de introducerea mesajului genetic la nivelul limfocitelor. Până acum, terapia CAR-T a fost descrisă atât drept terapie celulară și imunoterapie, cât și terapie genică ex vivo, deoarece a implicat reprogramarea genetică a limfocitelor în afara organismului uman.
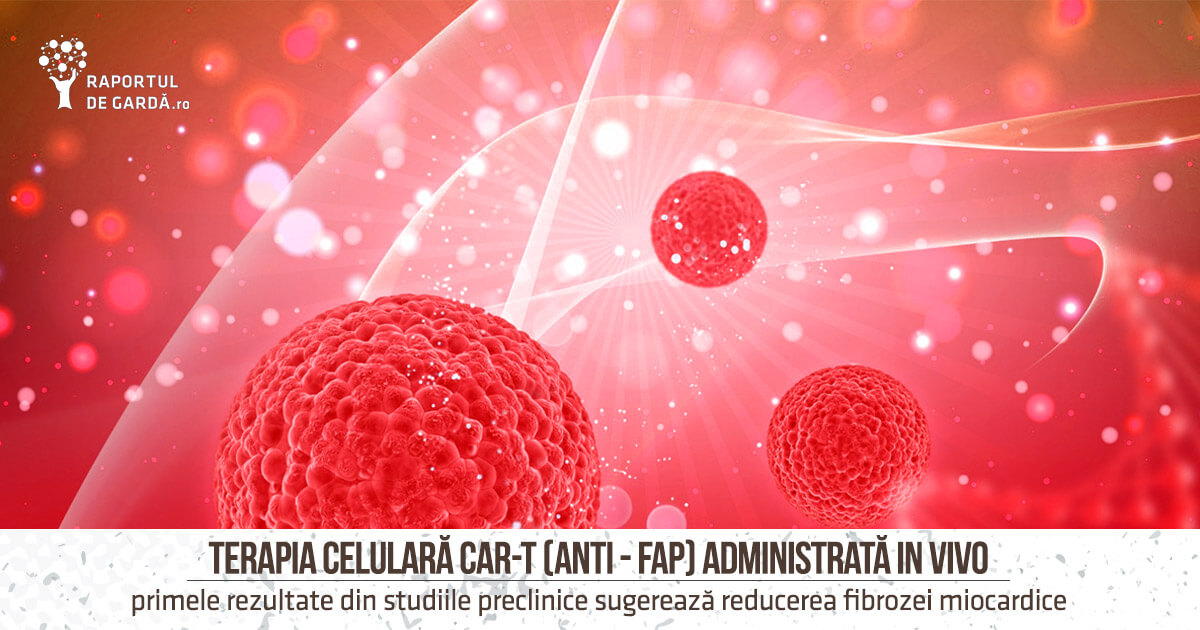
Obținerea celulelor CAR-T in vivo
Studiul publicat în Science aduce o nouă perspectivă asupra fabricației și aplicațiilor terapiilor CAR-T. La fel ca în cazul vaccinurilor COVID-19, s-a folosit o moleculă de ARN mesager, care codifică un antigen care recunoaște fibroblastele activate de la nivel miocardic. Fragmentul de ARN a fost introdus în organismul animalelor de laborator cu ajutorul unor nanoparticule lipidice care exprimă și anticorpi contra CD5, un receptor caracteristic limfocitelor T. Limfocitele T preiau ARN-ul și translatează instrucțiunile codificate sub forma receptorului FAP-CAR. La 24-48 de ore de la injectare, doar 15-22% din limfocitele care exprimă FAP-CAR sunt active, ulterior nivelul lor scade și într-o săptămână dispar.
Terapiile CAR-T de tip autolog folosite în oncologie pot persista timp de mai multe luni și chiar ani după ce sunt administrate, acestea demonstrând răspunsuri durabile, ceea ce este un obiectiv esențial la pacienții cu cancer. Însă, în cazul în care se țintește remodelarea cardiacă, scopul terapiei este diferit. Celulele fibroblastice sunt importante în vindecarea diferitelor leziuni, iar persistența unui răspuns care blochează FAP ar putea reprezenta un risc pentru pacienți. În țesutul normal, proteina FAP este exprimată în cantități scăzute și crește în procesul de vindecare a leziunilor, care implică activarea fibroblastelor. Terapia CAR-FAP are o activitate tranzitorie, deoarece blocarea producției FAP pe termen lung ar putea avea efecte nefavorabile.
Pentru realizarea studiului, s-a administrat terapia FAP-CAR la animale de laborator care prezentau fibroză miocardică. În următoarele 2 săptămâni funcția cardiacă s-a îmbunătățit semnificativ comparativ cu grupul de control (în care s-a indus fibroza, dar nu s-a administrat terapia CAR-T). La animalele tratate țesutul fibros de la nivelul ventricular a fost redus atât de mult, încât ecografic, țesutul cardiac arăta identic animalelor sănătoase. Singurul țesut fibros care rămâne este cel din jurul vaselor, deoarece la acest nivel nu este exprimată ținta FAP.
Cercetarea actuală deschide calea unor noi teme importante de explorat – de exemplu, fezabilitatea unei astfel de abordări pentru tratarea pacienților umani cu forme de fibroză severă sau care a persistat mai mulți înainte de administrarea terapiei, precum și găsirea unei soluții pentru țintirea fibrozei perivasculare. De asemenea, modificările matrixului extracelular pot influența fiziologia cordului, astfel încât trebuie evaluat, în studiile viitoare, efectul reducerii numărului de fibroblaste asupra mecanismelor biochimice și electrice de la nivel miocardic.
Platformele ARNm ar putea optimiza procesul de fabricație al terapiilor CAR-T
Spre deosebire de un medicament convențional, terapiile CAR-T sunt create special pentru fiecare pacient în parte, de aceea și procesul de fabricație necesită o schimbare radicală, de la producție la logistică și administrare. Procesul începe cu pacientul și folosește celulele imune ale pacientului care sunt modificate în laboratoare speciale și reintroduse în organism. Studiile clinice vizând terapiile CAR-T demonstrează atingerea unor obiective fără precedent: rate de remisiune de peste 90% % pentru anumite forme grave de cancere hematologice, pentru care toate opțiunile terapeutice erau epuizate. Terapia CAR-T este considerată o terapie „vie”, se regăsește în organism atâta timp cât există un antigen care poate fi țintit.
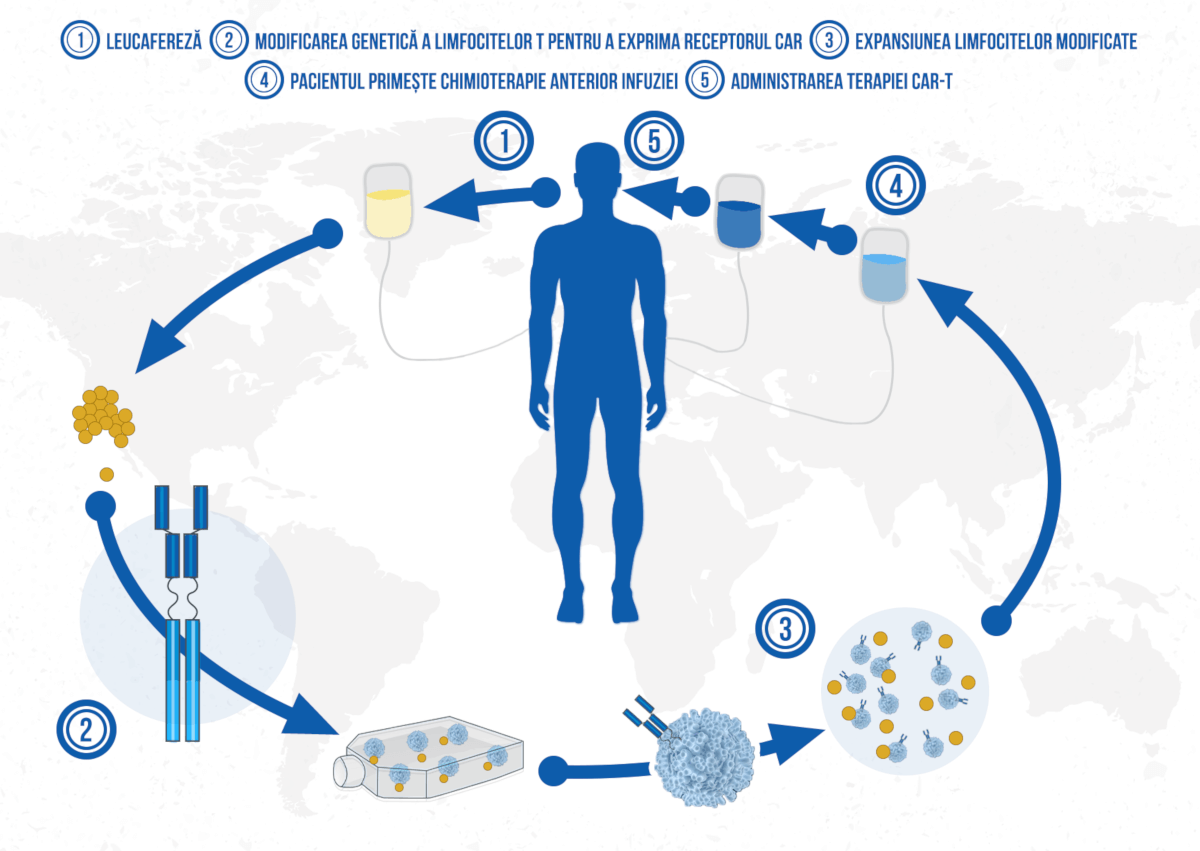
În schimb, în cazul medicamentelor de sinteză efectul este temporar, medicamentul este degradat în organism după o perioadă scurtă și pacientul necesită o nouă doză. Terapia CAR-T in vivo bazată pe administrarea de ARNm se comportă mai mult ca un medicament „clasic”, având un efect tranzitoriu, un mecanism care ar putea fi important pentru alte aplicații medicale, din afara oncologiei.
Tehnologia ARN mesager ar putea reprezenta o soluție cost-eficientă pentru dezvoltarea de terapii celulare CAR-T la scară largă. Avantajele ar include atât eliminarea procesului complex de fabricare, cât și reducerea posibilelor toxicități sau efecte nedorite (ex. ar elimina riscurile reprezentate de vectorii virali de tipul lentivirusurilor care se pot integra în genom, ar elimina necesitatea de chimioterapie înainte de administrarea CAR-T). Succesul vaccinurilor ARNm a stimulat cercetările și aplicațiile platformelor ARN și în alte domenii medicale.
Bolile cardiovasculare reprezintă principala cauză de mortalitate la nivel global, iar dintre acestea, insuficiența cardiacă se estimează a deveni o reală problemă de sănătate publică, pe fondul îmbătrânirii populației. Fibroblastele sunt activate ca răspuns la o injurie miocardiacă, inițial având efect benefic, de a repara leziunea, însă ulterior, în multe boli cronice cardiace se produce pe termen lung țesut fibros care rigidizează mușchiul cardiac și reduce funcția normală a inimii, complicându-se în final cu insuficiență cardiacă. Până în prezent, terapiile care evaluează agenți antifibrotici au avut efecte modeste. Dezvoltarea tehnologiilor ARN mesager ar permite extinderea imunoterapiilor și terapiilor celulare și în alte afecțiunile caracterizate de procese fibrotice, cum sunt multe boli hepatice sau renale.
Citește și:
- CAR-T, tratamentul oncologic creat pentru fiecare pacient în parte: care sunt provocările pentru extinderea utilizării terapiilor celulare în practică?
- Terapiile CAR-T, o nouă dimensiune a personalizării tratamentului oncologic: cum diferă față de terapiile clasice și care sunt progresele în managementul cancerelor hematologice

