Cum funcționează tehnologia ARN mesager folosită în vaccinurile COVID-19?
Primul vaccin din lume de tip ARN mesager (ARNm) care a fost aprobat pentru utilizare este BNT162b2, dezvoltat de Pfizer/BioNTech. Pfizer a anunțat, în urma analizei finale a studiului de fază III, că vaccinul BNT162b2 este eficient în 95% din cazuri împotriva COVID-19. Compania Moderna a raportat, de asemenea, o eficacitate de aproximativ 95% a vaccinului pe care l-a dezvoltat împotriva COVID-19. Ambele vaccinuri sunt produse prin aceeași tehnologie, care utilizează ARN-ul mesager (ARNm). În contextul pandemiei SARS-CoV-2, metodele clasice, complexe și îndelungate de producere a vaccinurilor nu ar fi putut asigura gestionarea adecvată a acestei crize de sănătate publică, favorizând dezvoltarea unor metode de obținere rapidă a unui vaccin și care asigură o producție pe scară largă, precum tehnica ARNm.
Mesaje cheie
- Utilizarea ARNm nu reprezintă un concept nou de dezvoltarea a vaccinurilor, care a fost descoperit în contextul pandemiei COVID-19
- Vaccinurile SARS-CoV-2 au depășit cu mult așteptările, valoarea prag considerată pentru Autorizația de Utilizare de Urgență de către FDA fiind reprezentată de o eficiență peste 50%
- La succesul acestor vaccinuri ARNm au contribuit resursele numeroase investite în obținerea lor, precum și experiența dobândită din studiile anterioare de dezvoltarea a acestei tehnici pentru alte boli infecțioase
- Vaccinurile de tip ARNm au un potențial care poate fi aplicat în prevenția și tratamentul a numeroase patologii
La succesul noilor vaccinuri împotriva SARS-CoV-2 au contribuit semnificativ cei 40 de ani de cercetare asupra ARN-ului mesager sintetic din cariera Dr. Katalin Kariko. Cercetătoarea a părăsit țara de origine (Ungaria) la vârsta de 30 de ani și a emigrat în Statele Unite, unde a studiat ARNm sintetic, în ciuda reticenței autorităților din lumea științifică, care au considerat nejustificată investirea de timp și resurse în acest domeniu. Dr. Kariko a fost, însă, perseverentă în cercetarea unui subiect care părea un capăt de drum.
Astăzi, în contextul unei crize de sănătate publică, oamenii de știință care au dezvoltat vaccinurile împotriva SARS-CoV-2 îi sunt recunoscători Dr. Katalin Kariko și consideră că nu ar fi putut obține aceste rezultate fără ajutorul studiilor desfășurate de aceasta în cei 40 de ani de cercetare a ARN-ului mesager sintetic.
„Nimănui nu ar trebui să îi fie frică. Poate că virusul este foarte complex, dar nu folosim virusul ca vaccin, nici un virus viu sau unul ucis. Folosim doar un ARN mesager care codifică o singură proteină, care este critică pentru generarea unor anticorpi neutralizanți în organismul uman, ceea ce înseamnă că va fi inhibată intrarea virusului în celulă. Chiar și când ai o infecție, celulele tale vor produce acel ARN mesager, ai produce acea proteină oricum. În cazul acestui tip de vaccin nu vei produce decât proteina de interes”, a declarat Dr. Katalin Kariko.
Ce reprezintă și ce funcție are ARN-ul mesager
Informația genetică necesară dezvoltării și funcționării întregului organism se află înscrisă la nivelul acizilor nucleici: ADN sau ARN. Acizii nucleici sunt alcătuiți din unități numite nucleotide, care, la nivelul genelor, alcătuiesc triplete ce reprezintă codoni. În funcție de tipul de bază azotată (adenină, timină, citozină, guanină), există 4 tipuri de nucleotide cuprinse în ADN, formând 64 de codoni posibili. 61 dintre aceștia corespund unor aminoacizi. Întrucât există doar 20 de aminoacizi naturali, mai mulți codoni pot codifica același aminoacid, purtând numele de codoni sinonimi. Această corespondență dintre codonii de la nivelul ADN-ului și aminoacizii cuprinși în proteine reprezintă codul genetic și este esențială pentru transformarea informației codificate prin nucleotide la nivelul ADN-ului în proteine.
Proteina nu este produsă prin citirea directă a nucleotidelor care intră în componența unei gene. Este necesară o moleculă intermediară, numită ARN mesager, care preia informația de la nivelul ADN-ului (proces numit transcripție) și o transportă din nucleu în citoplasmă, unde există aparatul necesar sintezei proteice. ARN-ul este, de asemenea, alcătuit dintr-o înșiruire de patru nucleotide, însă conține uracil în locul timinei.
În citoplasmă, organitele celulare responsabile de sinteza proteinelor sunt ribozomii. Un alt tip de ARN, numit ARN de transport (ARNt) are funcția de a aduce aminoacizii la ribozomi, existând 61 de tipuri de ARNt, care corespund aminoacizilor reprezentați prin cei 61 de codoni. Ribozomii „citesc” informația din ARNm și adaugă aminoacizii adecvați pe măsură ce parcurg codonii (proces numit translație). După alcătuirea lanțului de aminoacizi, acesta suferă diverse modificări pentru a forma proteina structural completă (modificări post translaționale).
Virusurile sunt patogeni care nu se pot replica fără a infecta o celulă gazdă, întrucât nu posedă aparatul necesar sintetizării acizilor nucleici și proteinelor. SARS-CoV-2 face parte din categoria de virusuri cu genom de sens pozitiv, ceea ce înseamnă că acidul nucleic al noului coronavirus poate funcționa direct ca ARN mesager, fiind translatat în proteine virale cu ajutorul ribozomilor celulei gazdă.

Cum funcționează vaccinurile ARNm
Vaccinurile ARNm utilizează codul genetic al patogenului, cu scopul de a produce un antigen de interes, care să stimuleze formarea de anticorpi protectori împotriva infecției. Antigenul reprezintă un compus ce nu este recunoscut ca aparținând organismului și, prin urmare, determină apariția unui răspuns imun.
După administrarea vaccinului, ARNm este folosit la nivelul celulelor organismului gazdă pentru a produce proteina codificată (antigenul). Această proteină nu este capabilă de a determina boala, dar este suficientă pentru a induce un răspuns imun care rezultă în producția de anticorpi.
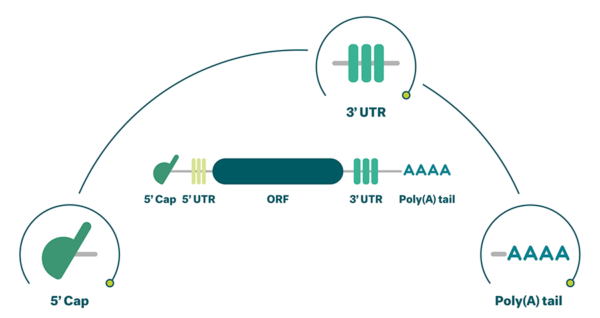
Vaccinurile ARNm se clasifică în non-replicative sau replicative. Ambele conțin secvența pentru antigenul de interes (open reading frame, ORF), în amonte și în aval de aceasta regiunile netranslatate 3` și 5` (UTRs), o coadă alcătuită din multiple unități de adenină (poly A tail) și învelișul 5`, reprezentat de 7-metilguanozină. Vaccinurile replicative prezintă în plus secvențele necesare pentru a asigura replicarea ARN-ului intracelular, ceea ce determină o sinteză ridicată a antigenului. Vaccinurile non-replicative au avantajul posibilității de control mai facil al tipului de răspuns imun indus, o sinteză mai ușoară și condiții de depozitare mai puțin stricte.
Calea de administrarea a vaccinurilor de tip ARNm este importantă pentru capacitatea de producere antigenului de interes și potența răspunsului imun indus. În funcție de localizarea dorită a expresiei antigenului, vaccinurile ARNm se pot administra local sau sistemic. Injectarea directă intramusculară, intradermică sau subcutanată reprezintă calea preferată în cazul bolilor infecțioase. Atunci când este necesară expresia sistemică a antigenului, în special cu scop terapeutic, este preferată administrarea intraperitoneală sau intravenoasă. Injectarea se poate realiza intravenos doar în urma realizării unor modificări ale moleculei de ARNm și a utilizării unor sisteme de livrarea speciale, deoarece ARNm este rapid degradat de ribonucleazele din sânge.
În urma administrării, sinteza proteinei virale în celulele umane atinge un maxim în 24-48 de ore și poate continua pentru câteva zile. ARNm nu pătrunde în nucleul celulei și este distrus după ce setul de instrucțiuni a contribuit la producerea fragmentului viral.
Utilizarea tehnologiei ARNm în realizarea vaccinurilor prezintă numeroase avantaje. Întregul proces de manufacturare este mai simplu față de tehnicile clasice și poate fi produs pe scară largă. ARNm este o moleculă mai puțin complicată decât o proteină și poate fi sintetizat printr-un proces chimic, nu biologic, fără a necesita utilizarea de culturi celulare sau ouă embrionate. Purificarea se realizează, de asemenea, mai ușor decât în cazul vaccinurilor clasice și contaminarea este puțin probabilă în lipsa necesității culturilor de celule. Timpul necesar pentru producția unui vaccin ARNm este scăzut, comparativ cu alte metode. ARN-ul mesager nu se poate integra în genomul celulei gazdă, ceea ce reprezintă un nivel de siguranță mai ridicat față de alte tipuri de vaccinuri.
În ceea ce privește răspunsul imun indus de vaccinurile ARNm, este stimulată atât imunitatea înnăscută, cât și cea adaptativă. Eficiența vaccinurilor clasice depinde de stimularea ambelor tipuri de imunitate și necesită utilizarea unor adjuvanți pentru îndeplinirea acestei condiții. Vaccinurile de tip ARNm stimulează imunitatea dobândită, dar și înnăscută, în absența adjuvanților. Așadar, aceste vaccinuri au proprietăți adjuvante proprii, induc un răspuns imun adaptativ puternic, prin stimularea producției de TNF-alpha (Tumor Necrosis Factor-alpha), IFN-alpha (interferon- alpha) și alte citokine produse de celulele sistemului imun.
Cum funcționează vaccinul de tip ARNm împotriva SARS-CoV-2
SARS-CoV-2 este un virus ARN, cu genom de sens pozitiv, care se replică în citoplasma celulei gazdă. Structural, este alcătuit din 4 proteine: proteina S (Spike), proteina E (envelope), proteina M (membrane) și proteina N (nucleocapsid). ARNm din vaccinul împotriva SARS-CoV-2 codifică proteina spike, un antigen viral important pentru stimularea răspunsului imun și apariția anticorpilor de tip protector. Acest proces mimează infecția cu SARS-CoV-2, dar în locul întregului virus este sintetizată doar o moleculă cheie pentru răspunsul imun, fără a determina infecția COVID-19.
Proteina S este un trimer alcătuit din două subunități (S1 și S2) și a fost identificată în februarie 2020. Subunitatea S1 cuprinde un fragment numit domeniu de legare a receptorului (RBD), prin intermediul căruia are loc atașarea la receptorul de pe suprafața celulei gazdă (ACE2 – angiotensin-converting enzyme 2). Subunitatea S2 mediază fuziunea cu membrana celulei gazdă. Interacțiunea ACE2-RBD declanșează modificări conformaționale complexe ale proteinei S, care determină fuziunea dintre anvelopa virală și membrana celulei gazdă, inițiind infecția la nivelul tractului respirator. Intracelular, virusul se replică, proteinele structurale sunt sintetizate, asamblate și împachetate în celula gazdă, apoi particulele virale sunt eliberate.
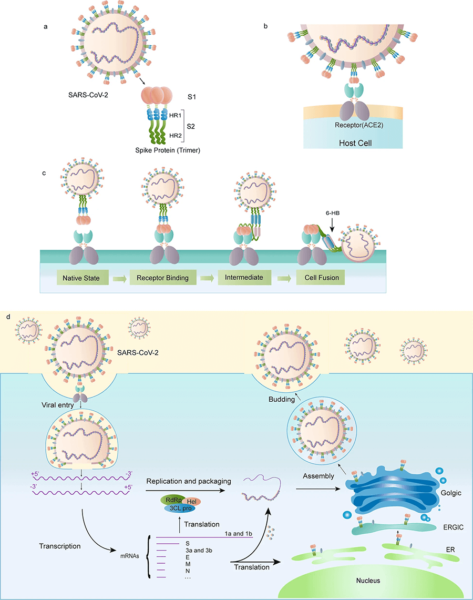
Prezența anticorpilor neutralizanți împotriva SARS-CoV-2 previne interacțiunea dintre proteina S și receptorul membranar, împiedicând apariția infecției. Acoperirea proteinei spike cu molecule polizaharidice este o metodă prin care virusul scapă de sub supravegherea răspunsului imun la pătrunderea în celulă. Prin urmare, proteina S este ținta principală a potențialelor vaccinuri și terapii împotriva COVID-19. Reproducerea cu maximă fidelitatea a acestei proteine printr-un vaccin determină un răspuns imun optim, protector față de o viitoare infecție SARS-CoV-2. Tehnologia ARNm permite sinteza proteinei spike cu o acuratețe ridicată, justificând rezultatele în urma testării in vivo a acestei metode.
RBD este o porțiune foarte importantă a proteinei S, fiind identificați anticorpi protectori împotriva acestui fragment, precum și limfocite T specifice. RBD este componenta imunodominantă a proteinei spike. Anticorpii care blochează RBD împiedică legarea la ACE2, în timp ce imunoglobulinele împotriva S2 sau a altor porțiuni ale S1 inhibă apariția modificărilor conformaționale și fuziunea. Mutații ale subunității S1 se asociază cu o afinitate crescută față de ACE2 și impun adaptarea dezvoltării vaccinurilor la apariția acestor modificări funcționale. Tehnologia ARNm este o metodă flexibilă în acest sens, conform declarațiilor reprezentanților companiei Pfizer, care au confirmat posibilitatea adaptării vaccinului BNT162b2 dacă genomul SARS-CoV-2 va suferi mutații.
Vaccinul BNT162b2 este de tip non-replicativ, conține nucleozide modificate și alterări ale RBD care îi cresc imunogenitatea. Moleculele de ARNm sunt asamblate în particule nanolipidice. Administrarea se realizează la nivelul brațului, unde celulele musculare utilizează ARNm pentru a produce proteina virală direct în corpul gazdei. Sunt necesare două doze, la un interval de 21 de zile. Vaccinul trebuie depozitat în ambalajul original, ferit de lumină, la temperaturi între -80 și -60 °C.
Patogenii care acționeză la nivelul mucoaselor, precum SARS-CoV-2, nu necesită doar anticorpi neutralizanți pentru protecția împotriva infecției, ci activarea unui răspuns imun atât înnăscut, cât și dobândit. Dacă în cazul altor vaccinuri, precum cel antigripal, succesul depinde de stimularea producției de anticorpi, pentru prevenția COVID-19, atât formarea anticorpilor, cât și imunitatea celulară reprezintă o necesitate. Limfocitele T CD4+ sunt importante pentru a optimiza răspunsul prin anticorpi și pentru a activa celulele CD8+. Dacă protecția prin anticorpi este incompletă, celulele citotoxice (CD8+) au un rol esențial pentru eliminarea virusului.
În urma studiilor clinice, majoritatea subiecților vaccinați cu BNT162b1 au prezentat un răspuns imun de tip Th1, cu expansiune a celulelor CD8 și CD4 pozitive, specifice pentru RBD, care produc interferon gamma. Aceste modificări sunt importante pentru realizarea protecției împotriva COVID-19. Prospectul vaccinului BNT162b2 aici.
De ce nu există mai multe vaccinuri ARNm aprobate în prezent?
Teoretic, cu ajutorul ARNm poate fi sintetizată orice proteină. Deși este mai ușor de produs decât proteinele în sine sau decât versiunile inactivate sau atenuate ale virusurilor care sunt folosite de obicei în vaccinuri, există însă și câteva provocări în realizarea acestora:
- Prin utilizarea ARNm nativ, fără optimizarea translației, sunt produse cantități scăzute de proteină;
- Molecula ARNm este degradată prea rapid în corpul uman;
- ARNm poate determina un răspuns inflamator puternic, în plus față de cel determinat de proteină;
- Instabilitatea, necesitatea depozitării la temperaturi foarte scăzute (-70 °C);
- Răspunsul imun umoral (care determină apariția anticorpilor) este mai scăzut față de cel indus de virusurile atenuate sau de proteinele virale;
Din cauza acestor dificultăți, numeroase grupuri de cercetare au preferat să se concentreze pe dezvoltarea unor vaccinuri prin alte tehnologii.
Tehnologia ARNm, deși este considerată mai simplă decât alte metode de producție a vaccinurilor, este un proces care presupune un echilibru între metoda de livrare, degradarea ARNm, intensitatea expresiei proteice și acuratețea cu care se realizează sinteza antigenului de interes, răspunsul imun favorabil (împotriva proteinei codificate) vs. cel nedorit (împotriva moleculei de ARNm). Optimizarea vaccinurilor ARNm trebuie să ia în considerare toate aceste aspecte și perfecționarea tehnicii a implicat o activitate intensă de cercetare. Dacă în cazul vaccinurilor clasice experiența în perfecționarea acestora este stăpânită de mai mulți ani, vaccinurile ARNm sunt un domeniu mai nou, care acum a ajuns la nivelul la care există suficiente cunoștințe și experiență pentru a obține rezultate eficiente. Este de așteptat ca, în viitor, mai multe vaccinuri ARNm să fie aprobate.
Eficientizarea vaccinurilor ARNm
Pentru a depăși dificultățile menționate anterior în obținerea unor vaccinuri eficiente și sigure de tip ARNm, a fost necesară identificarea unor condiții optime de producție și administrare.
Descoperirile esențiale, care au revoluționat dezvoltarea vaccinurilor ARNm, au aparținut Dr. Katalin Kariko și Dr. Drew Weissman de la Universitatea din Pennsylvania. La începutul anilor 2000, ei au constatat că modificarea nucleozidelor poate să crească producția proteică și să suprime răspunsul imun față de moleculele sintetice de ARNm introduse în organism. Kariko și Weissman, alături de Dr. Norbert Pardi, au descoperit că prin includerea ARNm în particule nanolipidice moleculele sunt protejate de degradarea rapidă post-administrare și pătrunderea acestora în celule este ridicată.
Pentru optimizarea vaccinurilor de tip ARNm, există în prezent numeroase opțiuni de alterare a acidului nucleic care influențează eficiența și stabilitatea. Alterarea secvenței care codifică proteina spike crește procesul de producție, spre exemplu, prin utilizarea codonilor sinonimi, care au o concentrație crescută a ARN-ului transportor corespunzător în citoplasmă, în locul celor rari, având drept consecință creșterea producției proteice. O translație foarte accelerată prin utilizarea de codoni frecvenți la nivelul ORF ar putea să împiedice modificările posttranslaționale ale unor proteine, care sunt foarte importante, deoarece este necesar ca antigenul să aibă conformația cât mai asemănătoare cu cea virală pentru a induce un răspuns imun optim. Din aceste considerente, expresia sintezei proteice trebuie reglată în funcție de rezultatul dorit. Recunoașterea ARNm străin de către senzorii imuni poate fi evitată prin utilizarea unor nucleozide modificate, precum pseudouridină, 5-metilcitidină. 1-metilpseudouridina are efect și de creștere a sintezei proteice in vivo.
Secvența poliadeninică încetinește degradarea realizată de exonucleaze, crește stabilitatea și timpul de înjumătățire și favorizează expresia proteinelor, iar învelișul 5′ este necesar pentru producția proteică eficientă. Elementele UTR influențează semnificativ stabilitatea și expresia ARNm: regiunea 3′ UTR prezintă numeroase elemente instabile și eliminarea acestora și /sau adăugarea unor elemente stabile crește stabilitatea ARNm. Anumite modificări ale secvenței 5’UTR pot crește stabilitatea ARNm și acuratețea expresiei proteice. Toate aceste elemente structurale de bază ale moleculei de ARNm conținute de vaccin pot fi prelucrate pentru a obține rezultate favorabile.
Purificarea este o metodă importantă de a preveni activarea nedorită a răspunsului imun înnăscut. Se poate realiza prin cromatografie lichidă de înaltă performanță (HPLC) sau prin cromatografie lichidă rapidă cu proteine (FPLC).
Timpul de înjumătățire poate fi influențat prin metodele de administrare. ARNm nu este suficient de mic pentru a traversa membranele celulare prin difuziune, iar sarcinile electrice prezente atât la nivelul membrelor, cât și în ARNm, îngreunează suplimentar acest proces. În plus, ribonucleazele extracelulare pot digera ușor molecula de ARNm. Se utilizează frecvent nanoparticule lipidice pentru a proteja ARNm de digestia rapidă și pentru a favoriza preluarea la nivel celular.
La dezvoltarea unor vaccinuri eficiente prin tehnologia ARNm împotriva SARS-CoV-2 a contribuit semnificativ experiența dobândită din studiile anterioare care utilizează această metodă pentru prevenția și tratamentul altor afecțiuni. Optimizarea a fost posibilă în urma identificării anterioare a soluțiilor pentru depășirea dificultăților impuse de această tehnică.
Alte aplicații ale ARNm, în curs de dezvoltare
Vaccinurile de tip ARNm sunt investigate pentru prevenția mai multor boli infecțioase, precum rabia, gripa, Zika, Ebola, infecția HIV, infecția cu virusul sincițial respirator, dar niciunul nu a ajuns încă într-o etapă avansată de studiu clinic. Producția unui vaccin antigripal ARNm sigur și eficient reprezintă o țintă importantă a dezvoltării acestei tehnici, întrucât procesul utilizat în prezent pentru obținerea vaccinurilor antigripale este lent și laborios, însă poate fi accelerat semnificativ prin utilizarea ARNm.
Există în curs de dezvoltare numeroase vaccinuri care utilizează tehnologia ARNm pentru prevenția și, mai ales, pentru tratamentul cancerului. Acestea codifică antigene asociate tumorilor care stimulează răspunsul imun de tip celular să elimine sau să inhibe celulele maligne. O parte dintre aceste vaccinuri au ajuns în studii clinice și se adresează proceselor neoplazice precum: melanomul, cancerul mamar, leucemia acută mieloidă, mielomul multiplu, mezoteliomul, glioblastomul, carcinomul renal, cancerul pancreatic, cancerul pulmonar non-microcelular, cancerul prostatic, gliomul malign, cancerul ovarian etc.
O altă potențială utilizare a vaccinurilor ARNm este reprezentată de imunoprofilaxie și imunoterapie pasivă (spre exemplu, în cazul unor infecții precum HIV, citomegalovirus, HPV etc.), prin utilizarea de molecule de ARNm care codifică lanțurile ușoare sau grele ale anticorpilor (imunoglobuline).
Citește și:
- Cum se acordă autorizarea condiționată de punere pe piață în Uniunea Europeană pentru vaccinurile împotriva COVID-19?
- Prospectul vaccinului Pfizer/BioNTech împotriva COVID-19 a fost publicat de guvernul britanic. Ce conține vaccinul și care sunt indicațiile?
- Esențial COVID-19: cele mai importante știri ale săptămânii. Pfizer a înaintat către FDA cererea de autorizare a utilizării de urgență pentru vaccinul SARS-CoV-2

