Darzalex Faspro, primul și singurul tratament aprobat de FDA pentru amiloidoza AL
DARZALEX FASPRO este primul și singurul tratament aprobat de FDA pentru amiloidoza cu lanțuri ușoare, nou diagnosticată, și marchează un progres semnificativ pentru această boală hematologică rară, fără opțiuni specifice de tratament. Aprobarea accelerată a regimului terapeutic combinat D-VCd, bazat pe DARZALEX FASPRO (daratumumab și hialuronidază-fihj, o combinație ce permite administrarea subcutanată a daratumumab), în asociere cu bortezomib, ciclofosfamidă și dexametazonă, a fost susținută de rezultatele studiului de fază 3, ANDROMEDA. S-a obținut o rată semnificativ mai mare de răspuns hematologic complet în urma regimului terapeutic D-VCd la pacienții adulți cu amiloidoză, o afecțiune rară asociată cu producerea și acumularea unei proteine anormale, care duce la deteriorarea organelor vitale, în special inimă, rinichi și ficat.
„Reușita de astăzi este un pas important pentru pacienții diagnosticați cu această boală rară”, a declar Isabelle Lousada, fondator și președinte al Amyloidosis Research Consortium. “Din păcate, majoritatea pacienților cu amiloidoză AL sunt diagnosticați la mai mult de un an de la debutul simptomelor inițiale, într-un moment în care este posibil să se confrunte deja cu deteriorarea organelor. Cred că această aprobare va spori gradul de conștientizare și educație cu privire la această boală amenințătoare de viață, și oferă o nouă speranță persoanelor cu amiloidoză AL, precum și persoanelor care le îngrijesc.”
DARZALEX FASPRO este singurul anticorp monoclonal anti-CD38 aprobat pentru administrare subcutanată în tratamentul pacienților cu mielom multiplu și, acum, amiloidoză AL.
Studiul clinic ANDROMEDA
Aprobarea accelerată din partea FDA se bazează pe rezultate pozitive din studiul ANDROMEDA, care au fost prezentate recent, la reuniunea anuală a Societății Americane de Hematologie (ASH 2020).
ANDROMEDA este un studiu de fază 3, randomizat, deschis, aflat în curs de desfășurare, care a evaluat DARZALEX FASPRO în combinație cu VCd (bortezomib, ciclofosfamidă și dexametazonă), comparativ cu VCd, un regim terapeutic utilizat frecvent la pacienții adulți diagnosticați recent cu amiloidoză AL. Studiul include 388 de pacienți cu amiloidoză AL nou diagnosticată, cu boală hematologică măsurabilă și cel puțin un organ afectat.
Pacienții au primit DARZALEX FASPRO subcutanat, o dată pe săptămână între săptămânile 1-8, o dată la două săptămâni între săptămânile 9-24 și o dată la patru săptămâni începând cu săptămâna 25 până la progresia bolii sau toxicitate inacceptabilă, pentru maximum 2 ani. Dintre pacienții care au primit regimul D-VCd, 74% au avut o durată de minim 6 luni a tratamentului iar 32%, peste un an.
Pacienții tratați cu DARZALEX FASPRO au prezentat o rată de răspuns hematologic complet (hemCR) mai mult decât triplă față de pacienții cărora li s-a administrat VCd singur (42% pentru regimul D-VCd, respectiv 13% pentru VCd).
„Există o nevoie urgentă de conștientizare și de opțiuni terapeutice pentru a ajuta în lupta împotriva acestei tulburări hematologice grave”, a declarat Dr. Raymond L. Comenzo, cercetător în cadrul studiului ANDROMEDA. „Obținerea răspunsului hematologic complet este un obiectiv terapeutic important, iar aprobarea de astăzi, pe baza acestui obiectiv clinic, va oferi medicilor și comunității medicale o nouă opțiune pentru a trata pacienții nou diagnosticați cu amiloidoză AL.”
Aprobarea continuă a DARZALEX FASPRO pentru această indicație este condiționată de verificarea și descrierea beneficiului clinic într-un studiu de confirmare.
Cele mai frecvente reacții adverse (≥20% dintre participanți) au fost infecții ale căilor respiratorii superioare, dispnee și tuse, greață, diaree, constipație, edeme periferice, fatigabilitate, neuropatie senzorială periferică, insomnie. Reacții adverse grave au apărut la 43% dintre pacienții cărora li s-a administrat DARZALEX FASPRO în asociere cu VCd. Reacțiile adverse fatale au apărut la 11% dintre pacienți.
Dintre pacienții cărora li s-a administrat DARZALEX FASPRO în asociere cu VCd, 72% au avut afectare cardiacă inițială: stadiul I Mayo (3%), stadiul II (46%) și stadiul III (51%). Tulburări cardiace grave au apărut la 16% dintre pacienți. Tulburări cardiace fatale au apărut la 10% dintre pacienții cărora li s-a administrat DARZALEX FASPRO în asociere cu VCd. DARZALEX FASPRO nu este indicat și nu este recomandat pentru tratamentul pacienților cu amiloidoză cu lanț ușor (AL) care asociază boală cardiacă clasa IIIB sau clasa IV NYHA / stadiul IIIB Mayo.
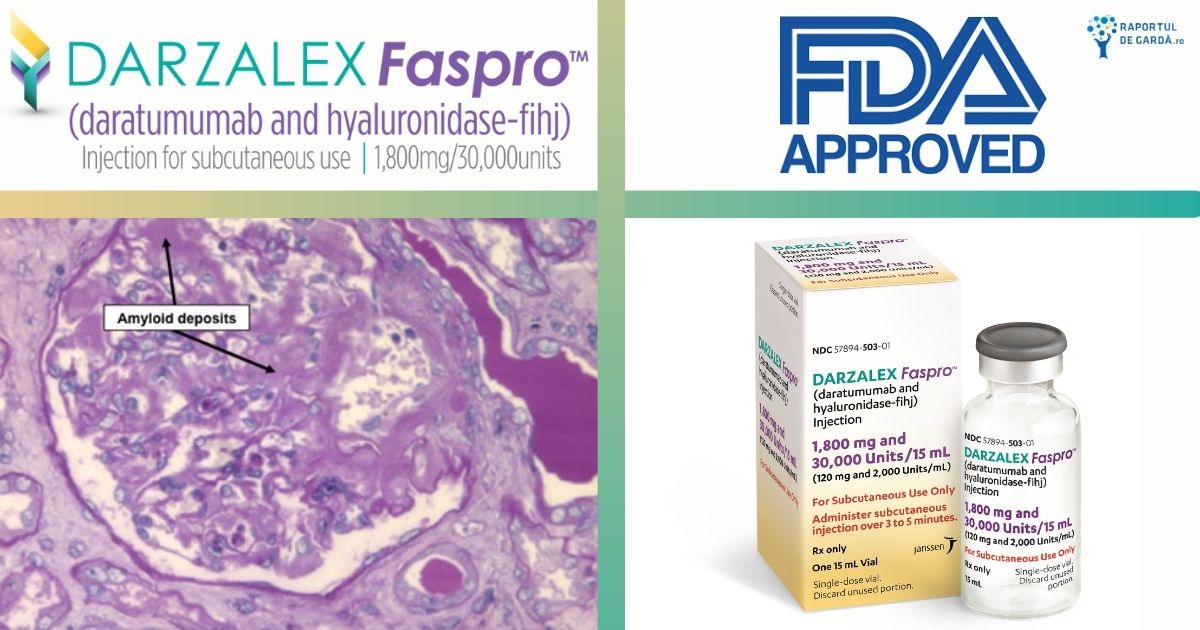
Despre amiloidoză
Amiloidoza este o tulburare multisistemică, amenințătoare de viață, în care celulele plasmatice din măduva osoasă hematogenă produc depozite de amiloid, care se acumulează și, în cele din urmă, determină deteriorarea organelor vitale. Boala poate afecta diferite organe, dar cel mai frecvent afectează inima, rinichii, ficatul, splina, tractul gastro-intestinal și sistemul nervos.
Aproximativ o treime dintre pacienți vizitează cel puțin cinci medici înainte de a primi un diagnostic, iar 72% sunt diagnosticați la peste un an de la apariția primului simptom. Pacienții au adesea un prognostic slab din cauza întârzierii în diagnosticarea bolii, care se manifestă de cele mai multe ori prin simptome nespecifice, ce imită alte afecțiuni frecvente. Până la 30% dintre pacienții cu amiloidoză AL decedează în primul an de la momentul diagnosticării.

