#DecodămCancerul. De la descifrarea genomului uman la descifrarea genomului cancerului: răspunsurile și provocările pe care medicina genomică le aduce în oncologie
O reducere de doar 10% a numărului de pacienți care nu răspund la tratamentele pentru diabet și boli cardiovasculare ar determina economii de 200 miliarde de dolari anual, conform statisticilor din SUA. Pentru a adresa problema răspunsului la tratament, descifrarea caracteristicilor moleculare ale bolilor este esențială. Există discrepanțe importante între complexitatea moleculară a patologiei umane și modul în care aceasta se traduce în practica medicală. Medicina genomică poate oferi soluții pentru aceste provocări. În oncologie, genomica determină deja schimbări majore, de la redefinirea cancerelor până la schimbarea standardelor terapeutice.
Descifrarea genomului uman a însemnat, printre altele, și faptul că nu mai este nevoie să definim normalul prin patologic – gena pentru hemofilie, gena pentru cancerul de sân, etc. Funcția genei BRCA1, de exemplu, este să repare ADN-ul când acesta suferă deteriorări. Varianta mutantă determină incapacitatea ADN-ului de a fi reparat. Descifrarea genomului uman înseamnă mai mult decât descoperirea și tratarea unor boli. Înseamnă înțelegerea identității, comportamentului, istoriei, definirea a ceea ce înseamnă sănătate, înseamnă o nouă știință.
Ascultați un nou episod al podcastului #DecodamCancerul, realizat în colaborare cu Centrul pentru Inovație în Medicină (susținut de Foundation Medicine și Roche) – De la descifrarea genomului uman la descifrarea genomului cancerului.
Podcastul este disponibil și pe:
Genetica este un domeniu care se referă la studiul genelor și a rolului lor în ereditate. Boli precum fibroza chistică sau hemofilia sunt considerate afecțiuni genetice. Diabetul, bolile cardiovasculare și cancerul sunt boli complexe, multifactoriale, și sunt determinate de interacțiunile dintre mai multe gene și mediu, și nu de către modificări ale unor gene individuale. Genomica e un termen mai recent care desemnează studiul tuturor genelor unei persoane și interacțiunile de la nivelul genomului.
În ciuda heterogenității, cancerele reprezintă patologii pentru care s-au putut identifica mai ușor ținte decât în cazul unor boli precum schizofrenia sau malformațiile cardiace congenitale. Fenotipul poate fi analizat relativ simplu. Genomul, poate fi, de asemenea, caracterizat la nivel de detaliu. Mutații punctiforme, variante structurale, modificările expresiei genice pot fi înregistrate și analizate cu tehnicile disponibile astăzi. Datele genomice, transcriptomice, proteomice de la nivel tumoral pot fi comparate cu variante normale. Integrarea biomarkerilor care provin din mai multe domenii „omice” are potențialul de a oferi mai multă valoare decât evaluarea modificărilor genetice, cu implicații numeroase în diagnosticul oncologic, alegerea terapiilor, realizarea studiilor clinice.
Descoperirea bazelor moleculare ale bolii
În `49, Linus Pauling demonstrează că anemia falciformă este cauzată de o modificare în structura hemoglobinei. Aceasta a fost denumită pentru prima dată o „boală moleculară”. În anii ‘70 s-a descoperit și mutația cauzatoare, după realizarea secvențierii genetice. S-au descoperit apoi și alte gene implicate în patologia umană, precum cele pentru hemofilie, fibroza chistică sau distrofii musculare.
Gena este o unitate a eredității, secvența de nucleotide care determină un produs funcțional (proteină). ADN-ul este molecula care poartă mesajele genetice. În 1962, Watson și Crick au primit premiul Nobel pentru descoperirea structurii ADN-ului. Descoperirea celor mai importante funcții ale ADN-ului depindea de înțelegerea structurii sale (capacitatea de a transmite informații de la celulă la celulă, de la organism la organism).
ADN-ul este format din două lanțuri care conțin drept unități de bază nucleotidele. Cele două lanțuri se orientează spațial în așa fel încât întreaga moleculă de ADN ia forma unui dublu helix. Fiecare lanț conține un cod scris din 4 litere – A,T,G,C – care se află mereu în oglindă cu perechea sa. În fiecare celulă se află în jur de 2 m din această moleculă, 200 kilometri daca o desfășurăm.
Diviziunea celulară este controlată strict în funcție de nevoile fiecărui țesut. Celulele care scapă de sub acest control sunt programate să se autodistrugă prin apoptoză. Acumularea mutațiilor este un proces îndelungat, de aceea, cancerul este predominant o boală a oamenilor vârstnici. Pentru ca o celulă să se transforme malign sunt necesare mutații multiple. Tumorile evoluează în etape, prin creșterea ratei de proliferare celulară și scăderea diferențierii celulare. Se consideră că tumorile apar mai frecvent în țesuturi care se divid mai rapid.
Mutațiile de la nivelul ADN-ului pot fi uneori transmise ereditar. Cel mai frecvent, acestea sunt sporadice (apar spontan și nu se transmit în mai multe generații).
Celulele de la nivelul unei tumori nu sunt identice. O tumoră nu poate fi considerată o masă de celule canceroase aglomerate într-un țesut normal. Există o heterogenitate celulară care include atât clonele de celule care se transformă malign, cât și celulele din mediul tumoral înconjurător. O adevărată provocare este identificarea evenimentelor care inițiază carcinogeneza, având în vedere variabilitatea și dinamica acestui proces.
Mutațiile driver sunt acele anomalii care au un rol major în inițierea și în progresia dezvoltării tumorale. Mutațiile driver se regăsesc mai des la nivelul regiunilor codante ale genomului și mai frecvent au origine somatică. Restul genelor mutante sunt numite gene pasager (passenger genes), care nu determină fenotipul bolii însă pot deveni driver.
Genele care dobândesc mutații driver pot fi clasificate în oncogene și gene supresoare tumorale.
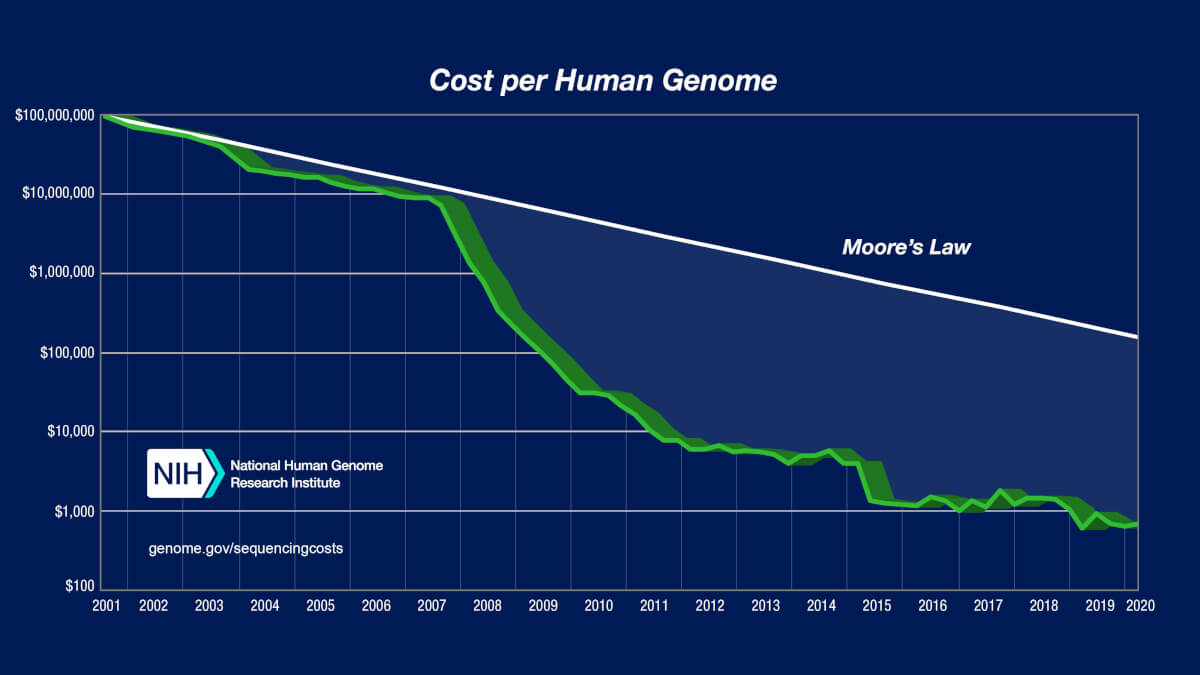
Prin testare genetică se realiza în mod clasic testarea moleculară detaliată asupra unor gene individuale sau analiza la nivelului întregului genom, dar printr-o metodă de „rezoluție mică” precum cariotiparea. Pentru Human Genome Project s-au folosit tehnologii de clonare și secvențierea Sanger, însă după 2003 dezvoltarea tehnicilor NGS permit secvențierea genomurilor în doar câteva zile.
După 2005, o serie de tehnici noi cunoscute sub numele de NGS (next-generation sequencing) au transformat atât aplicațiile secvențierii ADN-ului, cât și scara la care aceasta se poate realiza. Astfel, s-a putut trece de la secvențierea unor gene/exoni până secvențierea întregului exom (WES – whole exome sequencing), întregului genom (WGS – whole genome sequencing) și chiar la secvențierea transcriptomului.
Capacitatea de secvențiere a genomului cancerului a condus la identificarea de mutații driver, relația dintre diferite clone celulare în timp și spațiu demonstrând faptul că heterogenitatea entităților cunoscute sub denumirea de cancer determină și dificultatea identificării unor tratamente eficiente. Pe măsură ce tehnicile de secvențiere au evoluat, s-a ajuns la nivelul în care se poate extrage o cantitate mare de informație dintr-o probă mică de țesut, sau chiar de la nivelul fiecărei celule tumorale.
Descifrarea genomului cancerului
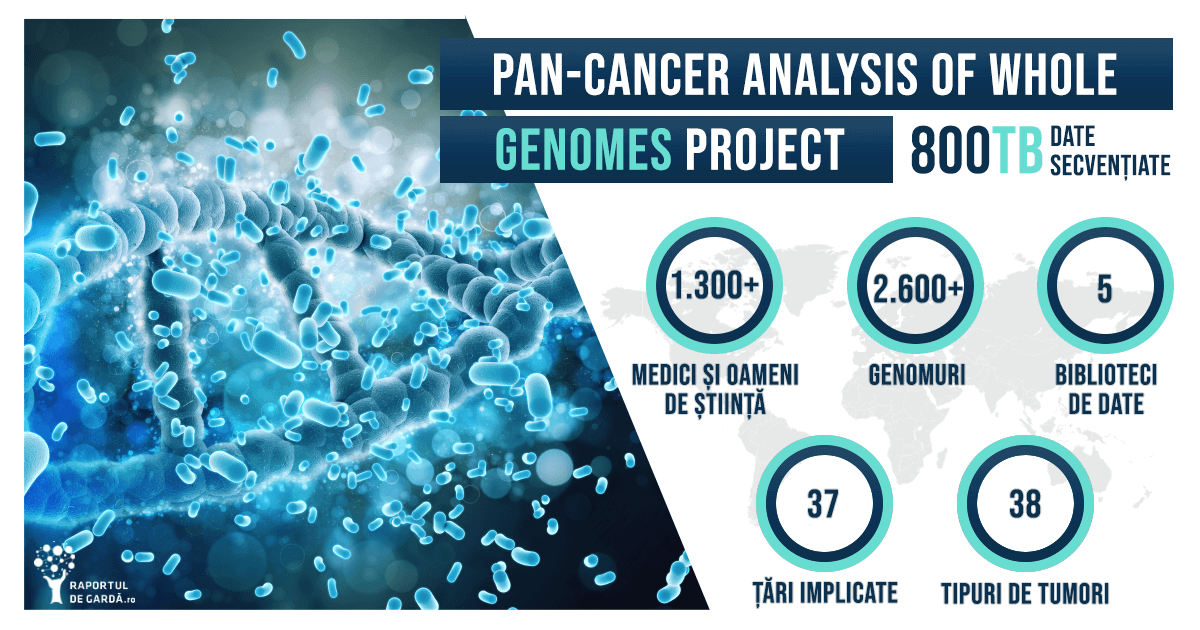
La începutul anului 2020, rezultatele proiectului Pan-Cancer Analysis of Whole Genomes Project (Pan Cancer Project) erau publicat în 23 de jurnale, reunind cea mai importantă analiză asupra mecanismelor moleculare implicate în cancer realizată vreodată. Secvențierea completă a 2.600 de genomuri, reprezentând 38 de tipuri tumorale diferite a fost realizată în cadrul unui proiect fără precedent.
95% dintre tumorile analizate prezentau cel puțin o mutație driver, comparativ cu analiza exomului, prin care se identificau doar 67% dintre aceste mutații. Fiecare tip de tumoră analizată prezenta în medie între 4 și 5 mutații driver. Doar 13% dintre mutațiile driver proveneau din regiuni ale genomului necodante. 93 de gene asociate cu mutații driver au fost identificate în regiunile necodante. Doar 19% dintre aceste gene erau cunoscute înainte de proiectul Pan Cancer Project.
Cele mai importante mutații au fost identificate aproape de gene implicate în fenomenul de splicing (mesajul copiat din ADN în ARN în cursul expresiei genice conţine o succesiune de secvenţe necodante numite introni, care vor fi eliminate)
Dacă perspectiva clasică asupra carcinogenezei implica acumularea progresivă de mutații, cromotripsia e un fenomen care explică acumularea rapidă a numeroase mutații, după doar câteva diviziuni celulare. În cadrul unuia dintre cele 23 de studii s-a demonstrat că la nivelul a 22% dintre cele 2500 de tumori analizate apare acest fenomen de instabilitate genomică numit cromotripsie definit prin ruperea unor fragmente de ADN și rearanjarea într-o poziție anormală. Cromotripsia este un proces care modelează genomul tumoral, duce la pierderea unor gene supresoare tumorale și la amplificarea oncologenelor, ceea ce conduce la stimularea creșterii tumorale. În acest context, o întrebare importantă este dacă acest fenomen în sine poate fi o țintă terapeutică.
În 2019 era publicat primul studiu care a evaluat utilitatea clinică a testării expresiei genelor, pe lângă identificarea anomaliilor genetice. În oncologie s-a demonstrat că testarea simultană atât a mutațiilor de la nivelul ADN-ului, cât și a transcriptelor ARN crește numărul pacienților care beneficiază de terapii țintite. Studiul a demonstrat că prin această strategie, 35% dintre pacienți au primit tratamentul personalizat.
Oncologia de precizie și noile tipuri de tratamente
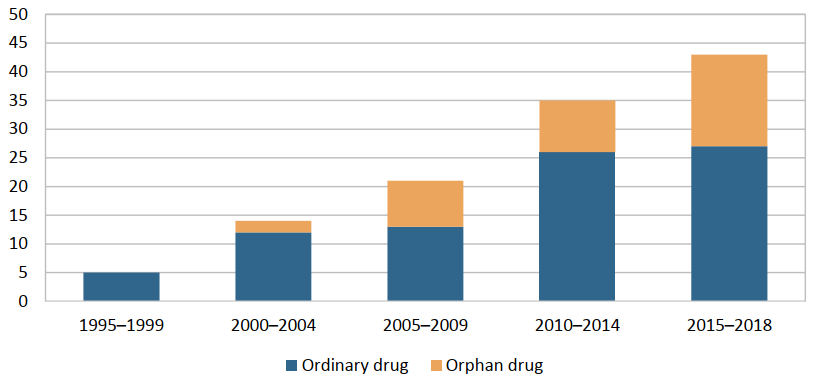
Medicamentele dezvoltate pornind de la ideea că acestea funcționează la fel pentru fiecare persoană sunt de domeniul trecutului. Peste 7.000 de medicamente sunt în dezvoltare în prezent, iar aproape jumătate dintre moleculele aprobate de FDA în ultimii doi ani sunt medicamente personalizate.
32% dintre terapiile aprobate în perioada 2010-2018 au statut de medicament orfan, comparativ cu 25% în perioada 1995 – 2009, conform „Comparator Report on Cancer in Europe 2019” realizat de IHE. Dezvoltarea de medicamente se îndreaptă spre indicații mai țintite, care pot fi definite prin intermediul genotipării, de exemplu. Indicațiile restrânse înseamnă că mai puțin pacienți beneficiază de un anumit tratament, dar beneficiul este mai mare.
Tratamentele oncologice clasice, precum chimioterapia, presupun administrarea de agenți citotoxici care nu discriminau între o celulă sănătoasă și una patologică. Noile medicamente care apar pe piață sunt țintite pe alterări moleculare – la nivel de ADN, ARN, la nivel de celule imune, etc. Unele terapii personalizate permit inclusiv considerarea anumitor tipuri de cancere drept vindecate. Cu toate acestea, o provocare majoră este dobândirea rezistenței la tratament, deoarece noi mecanisme sunt recrutate care întrețin procesul de carcinogeneză.
Cele mai multe boli implică mecanisme multiple care aparțin unor tipuri variate de celule. De aceea, tratamentele combinate încep să capete amploare. În cazul cancerului, inhibitorii punctelor de control, care cresc răspunsul imun, sunt combinate cu medicamente țintite.
În anii ‘80, infecția HIV era sinonimă cu o boală fatală. Astăzi, aceasta a devenit o boală cronică. Tratamentul include însă o combinație de 3 agenți care permit controlul bolii. În mod similar, în oncologie strategiile terapeutice combinate promit un management mai bun al cancerului.
Ratele de succes ale studiilor clinice se pot dubla dacă se folosesc biomarkeri pentru selecția pacienților, mai ales în oncologie
Secvențierea întregului genom și testarea panelurilor comprehensive permit extinderea numărului de pacienți care sunt incluși în studii clinice. De exemplu, pacienții care au un singur tip tumoral identificat pot fi incluși în studii de tip „umbrella” în care sunt direcționați într-un anumit braț al studiului care se potrivește profilului molecular. În alte tipuri de studii, pacienții pot prezenta mai multe tipuri de mutații și pot fi direcționați spre anumite tipuri de terapii off-label.
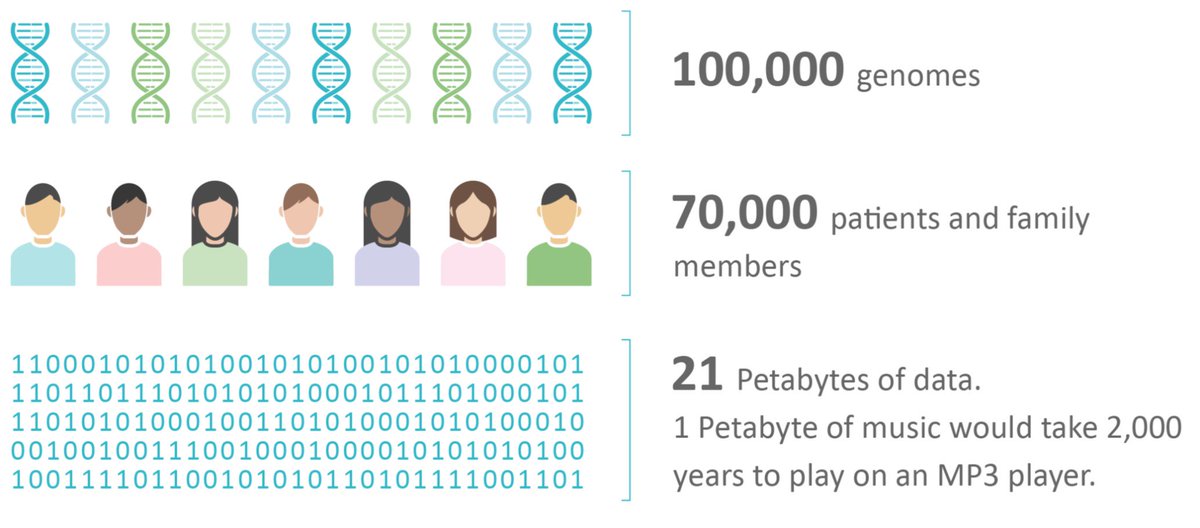
Astfel de studii includ pacienți cu forme metastatice de cancere, de aceea este esențial ca timpul necesar diagnosticului molecular să fie minim. În cadrul unui proiect major de secvențiere genomică desfășurat în UK, 100.000 Genomes Project, s-au realizat testări prin proceduri accelerate – timpul mediu pentru ca o probă să fie prelucrată și interpretată a ajuns la 10-20 zile.
Aplicarea medicinei genomice în programele naționale
Medicina genomică oferă noi soluții pentru diagnosticul și tratamentul pacienților cu boli complexe, care nu răspund la terapiile actuale. Un exemplu de succes în ceea ce privește integrarea medicinei genomice în practică o reprezintă Regatul Unit.
Genomics England a fost înființat în 2013, cu scopul secvențierii a 100.000 de genomuri de la 70.000 de pacienți cu peste 100 de boli rare și 7 tipuri frecvente de cancere și de la membri familiilor acestora. Datele obținute sunt conectate în registre, prin parteneriat cu NHS Digital și sunt disponibile atât industriei cât și mediului științific. Proiectul s-a încheiat în decembrie 2018. Până în prezent, pentru 1 din 4 pacienți cu boli rare s-au identificat anomalii genomice acționabile și pentru aproximativ 50% dintre cazurile de cancer există o terapie disponibilă sau un studiu clinic.
În ianuarie 2020, Genomics England și Illumina au anunțat un nou parteneriat cu scopul de a realiza 300.000 secvențieri genomice în următorii 5 ani, cu posibilitatea de a crește proiectul până la 500.000. Inițiativa se bazează pe succesul obținut prin secvențierea celor 100.000 de genomuri, dar și pe obiectivul setat de secretarul de stat din Ministerul Sănătății Matt Hancock de a analiza până la 5 milioane de genomuri până în 2024.
Abilitatea de a genera informația genomică a depășit abilitatea de interpretare a semnificației acestei informații în beneficiul fiecărui pacient. Deși progresul tehnologic schimbă din multe puncte de vedere sistemul medical și cercetarea, există o mare provocare în introducerea analizelor genomice în practică.

