FDA aprobă neratinib în tratamentul cancerului mamar avansat local sau metastatic, cu mutații HER2, care a primit deja două linii terapeutice antiHER2
Administrația Alimentelor și Medicamentelor din SUA (FDA) a aprobat neratinib (denumire comercială Nerlynx, produs de Puma Biotechnology, Inc.), pentru a fi utilizat în combinație cu capecitabina, la pacienții adulți cu cancer mamar avansat local sau metastatic, care prezintă mutația HER2 și au în antecedente cel puțin două linii terapeutice anti-HER2. Această aprobare survine în urma rezultatelor pozitive obținute în studiul NALA de fază III.

Studiul NALA
Studiul de fază III NALA a avut o metodologie comparativă, cu grup de control și grup de intervenție, în care cei 621 de pacienți au fost alocați în mod aleator. Toți au primit capecitabină, și în plus în grupul de studiu a fost administrat neratinib, iar în cel de control – lapatinib. Toți pacienții tratați au fost diagnosticați cu cancer mamar HER2-pozitiv stadiul IV și au primit cel puțin două terapii antiHER2 în antecedente, iar 30,8% dintre aceștia aveau 3 sau mai multe terapii antiHER2. În 80,5% dintre cazuri, pacienții prezentau și localizări viscerale metastatice, iar 59,1% dintre tumori exprimau și receptori hormonali.
Efectele antitumorale ale neratinib s-au dovedit încurajatoare:
- Supraviețuirea în grupul de tratament a fost, în medie, de 8,8 luni (6,6 luni în grupul de control);
- Neratinib a scăzut riscul de progresie tumorală sau deces cu 24%;
- La 6 luni de urmărire, 47,2% și, respectiv, 37,8% dintre pacienți erau în viață și lipsiți de progresie tumorală (progression-free survival) în grupul de studiu și, respectiv, tratament;
- La 12 luni de urmărire aceste proporții au fost de 28,8% și, respectiv, 14,8%;
- Alți parametri ameliorați de neratinib, fără a atinge pragul de semnificație statistică, sunt:
- Rata de supraviețuire globală la 6 luni (90,2% vs 87,5%) și la 12 luni (72,5% vs 66,7%);
- Rata de răspuns globală a fost de 32,8% în grupul de studiu, față de 26,7% în grupul de control.
Profilul de siguranță a neratinib a fost similar terapiei din grupul de control (lapatinib): rata de reacții adverse a fost similară între cele două grupuri, însă neratinib a condus la o proporție mai mare de diaree (24,4% vs 12,5%). Mai puțini pacienți din grupul de studiu au întrerupt tratamentul datorită reacțiilor adverse (10,9%, față de 14,5% în grupul de control). În grupul de control, 29,9% dintre pacienți au suferit reacții adverse grave, față de 33,99% în grupul de studiu.

Despre neratinib
Neratinib acționează prin inhibarea tirozin kinazelor, un set de enzime cu rol de stimulare a diverselor procese intracelulare. Molecula terapeutică se atașează de proteina HER2, exprimată la suprafața celulelor tumorale, și inhibă cascada de procese enzimatice stimulate, în mod normal, de HER2. Astfel, neratinib inhibă procesul de creștere și diviziune a celulelor canceroase.
Nerlynx este aprobat de Agenția Europeană a Medicamentului (EMA), în Uniunea Europeană, din 2018, pentru tratamentul adjuvant al formelor incipiente de cancer mamar care prezintă atât receptori hormonali, cât și mutații care amplifică expresia HER2, la pacienții care au primit, în anul anterior, tratamentul anti-HER2 cu trastuzumab. Terapia adjuvantă este administrată în urma exciziei chirurgicale a cancerului localizat și are rolul de a scădea riscul de apariție a metastazelor și recurențelor tumorale. În SUA, FDA a aprobat din 2017 Nerlynx, pentru aceeași indicație.
În cazul acestei noi aprobări, neratinib a beneficiat de o serie de instrumente, dezvoltate de FDA cu scopul facilitării accesului pacienților la noile terapii (Assessment Aid și analiza prioritară a dosarului de aprobare – Fast Track), ceea ce a condus la o aprobare anunțată cu o lună mai devreme decât data-limită stabilită inițial.

În Statele Unite, se estimează că pe parcursul anului 2019 au fost diagnosticate 268.600 de cazuri de cancer mamar invaziv la femei și 2.670 de cazuri la bărbați. În același an, aproximativ 41.760 de decese pot fi atribuite acestei boli (la femei, și 500 la bărbați). Riscul este ridicat la femei: aproximativ o femeie din 8 (13%) vor primi un diagnostic de cancer mamar invaziv de-a lungul vieții, iar 1 din 39 (3%) vor deceda în urma acestuia.
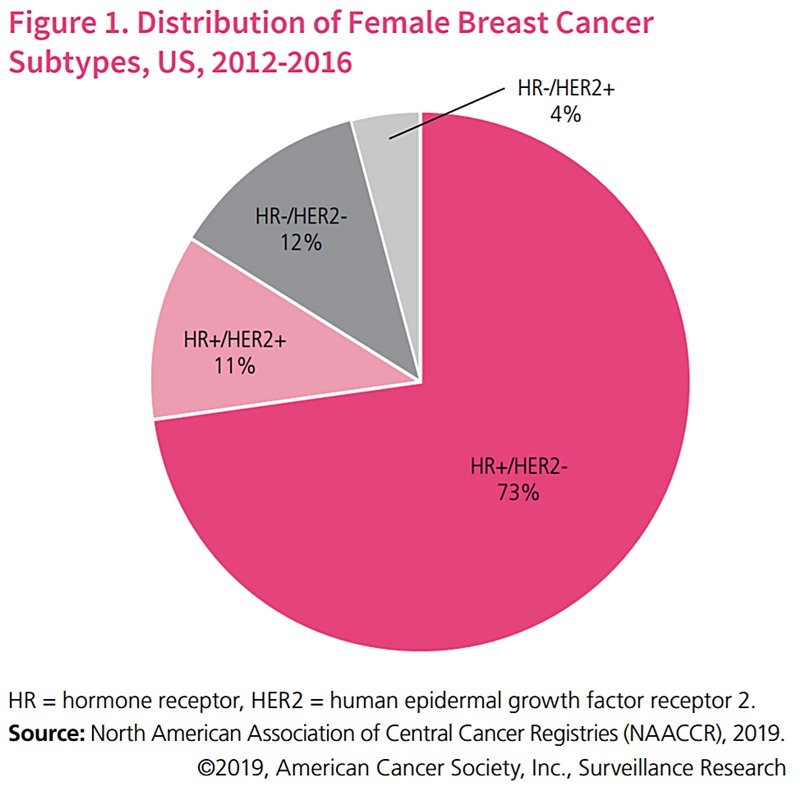
Cancerul mamar HER2-pozitiv reprezintă un subgrup important al acestei clase tumorale: aproximativ 10-20% din totalul cazurilor prezintă o supraexpresie a acestei gene. La 5 ani de la diagnostic, 83% dintre pacienții care prezintă forme de cancer HER2+ sunt în viață, și 89% dintre pacienții care prezintă forme de cancer HR+/HER2+ (pe lângă mutații HER2, tumora prezintă și receptori pentru hormonul estrogen).
Citește și:
- Combinația de pertuzumab cu trastuzumab și docetaxel crește cu 37% supraviețuirea la 8 ani în cancerul de sân HER-2 pozitiv metastazat
- Rata de remisiune completă este superioară în cancerul de sân HER2-negativ tratat cu durvalumab și olaparib, adăugate la paclitaxel, comparativ cu chimioterapia clasică
- FDA aprobă trastuzumab deruxtecan pentru tratamentul cancerului de sân HER2-pozitiv avansat

