Neoantigenele P53 și RAS ar putea fi pentru prima dată țintite terapeutic printr-un nou tip de imunoterapie bazată pe anticorpi bispecifici
În 1979 era descoperită gena TP53, cunoscută și sub numele de „gardianul genomului”, o genă supresoare tumorală cu rol în menținerea stabilității genomului, cea mai cunoscută genă driver, care prezintă mutații în peste 50% din cancerele umane. Studierea acesteia a generat peste 65.000 de lucrări științifice și investiții estimate la 6,5 miliarde de dolari. Cu aproape 40 de ani în urmă au fost identificate și genele RAS, primele oncogene descoperite în tumorile umane. În ciuda acestor eforturi, până în prezent nu există tratamente specifice aprobate pentru cancerele care prezintă mutații la nivelul acestor gene.
Două studii preclinice publicate recent în Science arată că neoantigenele derivate din genele TP53 și RAS ar putea fi țintite cu ajutorul unor noi imunoterapii, bazate pe anticorpi bispecifici. Deși sunt în faze incipiente, rezultatele acestor studii sunt relevante pentru că pot valida o nouă generație de terapii bazate pe produse biotehnologice avansate.
Semnificația acestor studii poate fi rezumată prin două mesaje principale:
- Utilizarea anticorpilor bispecifici a condus la activarea limfocitelor T și liza celulelor tumorale în ambele studii, atât in vitro cât și in vivo și regresia tumorilor cu mutații la nivel TP53 și RAS.
- Au fost identificate sintetice bazate pe fragmente de anticorpi (de tipul anticorpi bispecifici) care se pot lega cu specificitate de neoantigene derivate din P53 și RAS, chiar în condițiile în care acestea au o expresie extrem de scăzută pe celulele tumorale și până acum erau inaccesibile oricărui agent farmacologic;
Detectarea TP53 și RAS pe suprafața celulelor tumorale
Una dintre cele mai cunoscute abordări în imuno-oncologie este utilizarea anticorpilor monoclonali, însă în ultimii ani, datorită progreselor biotehnologiei, categoriile de anticorpi care pot fi folosite ca agenți terapeutici s-au extins.
Proteinele P53 și RAS mutante, fiind intracelulare, nu pot fi țintite cu ajutorul anticorpilor „clasici”, care sunt molecule mari, ce acționează mai ales la suprafața celulară unde pot întâlni o țintă accesibilă. În celule, proteinele sunt degradate la nivelul proteazomilor în fragmente mai mici numite peptide, iar o parte dintre acestea sunt prezentate pe suprafața celulei (de sistemul HLA). Atunci când proteinele p53 și RAS sunt degradate, la nivelul suprafeței celulei apar peptide care pot fi detectate de sistemul imun numite neoantigene. Până acum, cele două proteine mutante erau inaccesibile agenților farmacologici iar neoantigenele nu puteau fi țintite pentru că aveau o expresie aproape nedetectabilă la suprafața celulei (există sub 10 copii per celulă).
Oncogene și gene supresoare tumorale
Mutațiile driver sunt acele anomalii genetice care au un rol major în inițierea și în progresia dezvoltării tumorale. Genele care dobândesc mutații driver pot fi clasificate în oncogene și gene supresoare tumorale. Restul genelor mutante sunt numite gene pasager (passenger genes), care nu determină fenotipul bolii, însă pot deveni driver.
Proto-oncogenele sunt gene normale care contribuie la creșterea celulară. Atunci când o proto-oncogenă e mutantă, aceasta poate deveni activată și se transformă într-o oncogenă (ex. KRAS, EFGR), ceea ce conduce la apariția cancerului prin creșterea necontrolată a celulelor. Genele supresoare tumorale (ex. TP53, BRCA2, Bcl2 etc.) sunt implicate în mod normal în repararea erorilor de la nivel ADN, în încetinirea diviziunii celulare și apoptoză. Atunci când aceste gene prezintă mutații, celulele pot crește de asemenea, necontrolat. O diferență importantă între oncogene și gene supresoare tumorale este că oncogenele rezultă din activarea proto-oncogenelor, iar genele supresoare tumorale conduc la cancer atunci când sunt inactivate.
Terapiile oncologice folosite în prezent în practica medicală țintesc oncogene, mai frecvent decât gene supresoare tumorale. De-a lungul timpului au fost descoperite medicamente care inactivează proteine codificate de alte oncogene cum ar fi EGFR sau BRAF. Acestea inhibă în general acțiunea proteinelor. Proteinele codificate de genele supresoare tumorale sunt deja inactivate. Reactivarea acestor proteine cu ajutorul agenților farmacologici este o adevărată provocare.
Secvențierea de nouă generație, împreună cu proteomica și instrumentele de bioinformatică au accelerat descoperirea de neoantigene asociate mutațiilor (MANAs, mutation-associated neoantigens), care reprezintă un tip de antigene tumorale specifice (se află doar pe celulele canceroase, nu și pe cele normale).
Țintirea „gardianului genomului”. Rolul anticorpilor sintetici
Mai mult de 75 de milioane de oameni sunt diagnosticați cu neoplasme care prezintă mutații la nivelul genei TP53. Atunci când gena TP53 este inactivată la nivel tumoral, celulele pot prolifera necontrolat. Activarea sa este mai dificilă decât inhibarea activității sau oprirea producției produsului codificat de această genă – proteina p53.
Un studiu publicat în Science a demonstrat că folosind fragmente de anticorpi recombinate (de tip bispecific diabodies) se poate obține recunoașterea cu specificitate a produsului codificat de o genă supresoare tumorală inactivată.
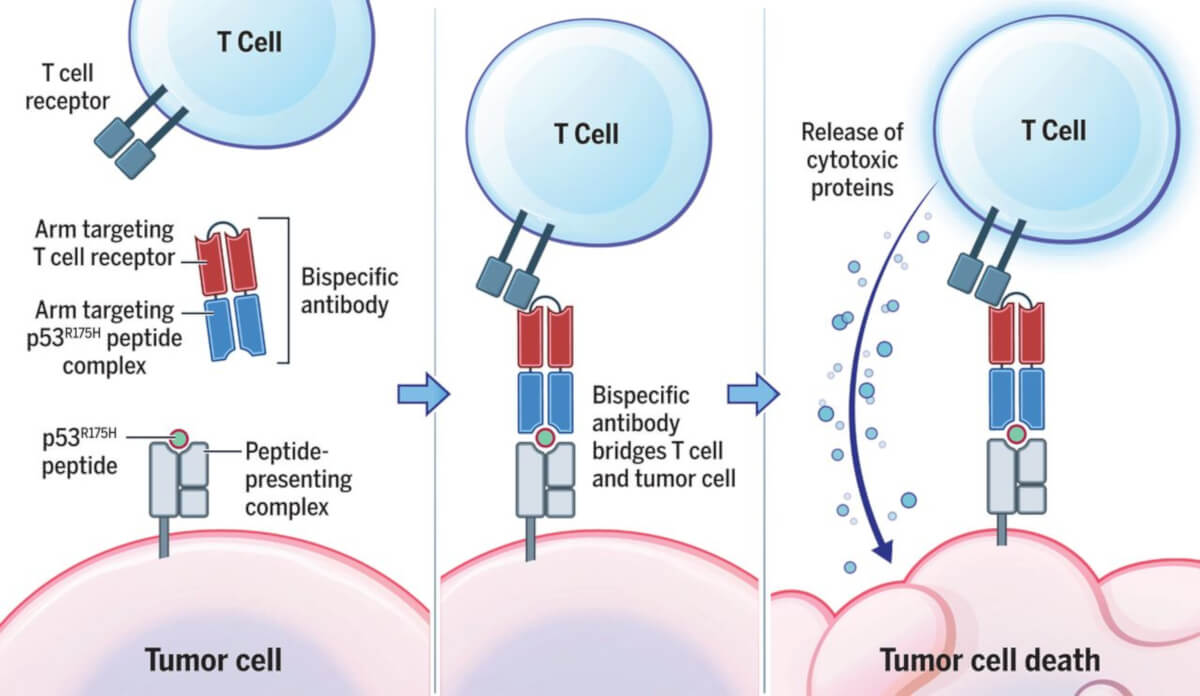
Anticorpii „clasici” au două brațe cu care se leagă de un antigen, în timp ce anticorpii bispecifici sunt proteine artificiale alcătuite dintr-un braț care se leagă de celula imună (limfocitul T) și cu alt braț se leagă de o proteină de la suprafața celulei canceroase, funcționând ca o punte între cele două. Astfel, celula imună este activată să poată ataca celula transformată malign. Prin termenul de „diabodies” sunt definiți cei mai mici anticorpi bispecifici, obținuți prin conectarea a două fragmente variabile de lanțuri grele și ușoare de imunoglobuline.
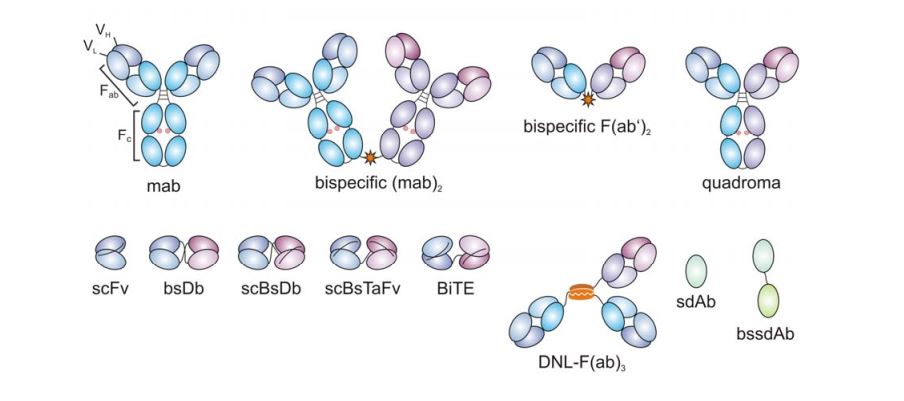
Prin tehnica phage display s-au selectat mai multe fragmente variabile de anticorpi, dintre care s-a identificat H2, un fragment de anticorp care se leagă cu afinitate de complexul P53-HLA. Acesta a fost transformat într-un potențial agent terapeutic prin fuziunea cu un alt fragment de anticorp care se poate lega de un receptor de pe limfocitul T (CD3). Prin combinarea celor două fragmente se obține o structură numită bispecific diabody (bsDB) care poate recunoaște cancerele care exprimă un neoantigen p53. Anticorpul bispecific a condus la regresia xenogrefelor tumorale la șoareci de laborator, atât imediat după inducerea tumorilor cât și după ce acestea s-au dezvoltat.
Prin bsDB se pot activa limfocitele T chiar și când antigenul este exprimat la niveluri foarte scăzute și induce activitate citotoxică și producerea de multiple citokine, care probabil reprezintă explicația pentru activitatea antitumorală in vivo.
Țintirea neoantigenelor RAS
Și pentru mutațiile de la nivelul genei RAS a fost dificil să se identifice agenți farmacologici eficienți, din cauza structurii proteinei mutante și lipsei locurilor de legare. Mutațiile la nivelul familiei de gene RAS (KRAS, HRAS și NRAS) apar în aproximativ 25% dintre cancerele umane. Cele mai multe eforturi de cercetare a unor noi agenți terapeutici pentru aceste tipuri de cancere explorează molecule mici, nu terapii bazate pe anticorpi, pentru că proteinele RAS sunt intracelulare. Peptidele derivate din mutații ale genei RAS sunt prezentate pe celulele canceroase prin intermediul a două alele HLA (HLA-A3 și HLA-A1).
Un studiu publicat în Science Immunology are o abordare similară celei descrise anterior: s-au identificat fragmente variabile de anticorpi (scFvs) specifice structurii peptid RAS – complex HLA. Au fost testate mai multe variante de anticorpi (bispecific, T-cell engager, etc) și s-a descoperit că varianta optimă a fost prin obținerea unei structuri de tip single chain diabody (scDb), care conține două fragmente scFV, dintre care unul cu specificitate anti-CD3. Acest tip de anticorp bispecific permite activarea limfocitelor T și distrugerea celulelor tumorale RAS+.
Pașii următori
Pentru a trata oameni cu astfel de terapii sunt necesari anticorpi care să fie dezvoltați în funcție de particularitățile imune ale pacientului, dar și în funcție de mutațiile p53 sau RAS care sunt prezente la nivel tumoral. Pentru că lipsește regiunea constantă, acești anticorpi modificați dispar mai repede din sânge, de aceea, probabil o modalitate de administrare în organismul uman ar fi cu ajutorul unor pompe care permit infuzia continuă timp de mai multe săptămâni. De asemenea, trebuie luat în considerare și micromediul tumoral, care limitează multe dintre aplicațiile imunoterapiilor actuale în tumorile solide.
După identificarea formulei optime de livrare în organismul uman pentru validarea acestora vor fi necesare studii clinice pentru evaluarea eficacității și siguranței la pacienții oncologici.
Cu toate acestea, studiile menționate anterior reprezintă un punct de plecare pentru obținerea de imunoterapii off the shelf, bazate pe proteine care ar putea funcționa ca tratamente în cancere ce exprimă antigene tumorale specifice.
Citește și:
- Tehnologia BiTE, o nouă dimensiune a imunoterapiei oncologice. Ce sunt anticorpii bispecifici și care este diferența față de terapia CAR-T?
- Prof. Dr. Tudor Ciuleanu, despre cele mai importante noutăți în cancerul pulmonar de la ASCO și ESMO 2020 – PARTEA II: testarea comprehensivă genomică și tratamentul cu anticorpi bispecifici

