Pentru a combate contrafacerea, România va implementa din februarie 2019 un Sistem Național de Verificare a Medicamentelor
Începând cu 9 februarie 2019, Uniunea Europeană va combate în mod activ comercializarea medicamentelor falsificate folosind Sistemului Național de Verificare a Medicamentelor care va fi pus în funcțiune în toate statele membre.
Astăzi, principalii actori din sistemul de sănătate românesc s-au reunit la Palatul Parlamentului în cadrul evenimentului „Siguranța Pacientului prin Siguranța Medicamentului”. Evenimentul a marcat lansarea oficială a procesului de implementare a Sistemului Național de Verificare a Medicamentelor în România și a confirmat angajamentul tuturor părților angrenate în implementarea noii legislații, de la reprezentanții industriei farmaceutice, până la autoritățile direct implicate, precum Ministerul Sănătății și Agenția Națională a Medicamentului și a Dispozitivelor Medicale. Autoritățile prezente și-au asumat să asigure finalizarea proiectului național la termenul stabilit și să ofere tot sprijinul Organizației de Serializare a Medicamentelor (OSMR) în vederea implementării sistemului în cele mai bune condiții.

„Astăzi a fost demarat oficial și în România procesul de implementare a Sistemului European de Verificare a Medicamentelor, sistem care va deveni operațional în toate țările UE începând cu 9 februarie 2019. De la această dată, doar medicamentele care respectă noile reguli de securitate vor putea fi puse în circulație pe teritoriul Uniunii Europene. Serializarea medicamentelor este o inițiativă esențială pentru siguranța și sănătatea pacienților, în condițiile în care pericolul intrării medicamentelor falsificate în lanțul comercial este tot mai mare. Aceasta este prima directivă europeană a cărei implementare și finanțare intră 100% în sarcina sectorului privat, respectiv a industriei farmaceutice” – Dan Zaharescu, Președintele Organizației de Serializare a Medicamentelor din România (OSMR)
Sistemului Național de Verificare a Medicamentelor are la bază Regulamentul Delegat UE nr. 2016/161, care stipulează obligativitatea introducerii elementelor de siguranță pe medicamentele cu prescripție și pe anumite medicamente fără prescripție, menționate de legislație și în acest mod se garantează autenticitatea medicamentelor și se previne intrarea medicamentelor falsificate în lanțul legal european de comercializare.
Conform regulamentului UE, fiecare țară europeană trebuie să pună la punct un Sistem Național de Verificare a Medicamentelor, ce va fi implementat și administrat de către o organizație națională a industriei farmaceutice. Scopul acestui Sistem este să funcționeze ca o platformă unde toți actorii interesați, de la producători, la distribuitori, la farmacii sau spitale, să poată verifica autenticitatea medicamentelor, prin verificarea identificatorului unic al fiecărui produs. Sistemul național va fi conectat la un sistem european, EU-Hub, ce va integra și centraliza datele și informațiile de la nivelul Uniunii Europene. În România, implementarea sistemului de serializare va fi coordonată de către Organizația de Serializare a Medicamentelor din România (OSMR).
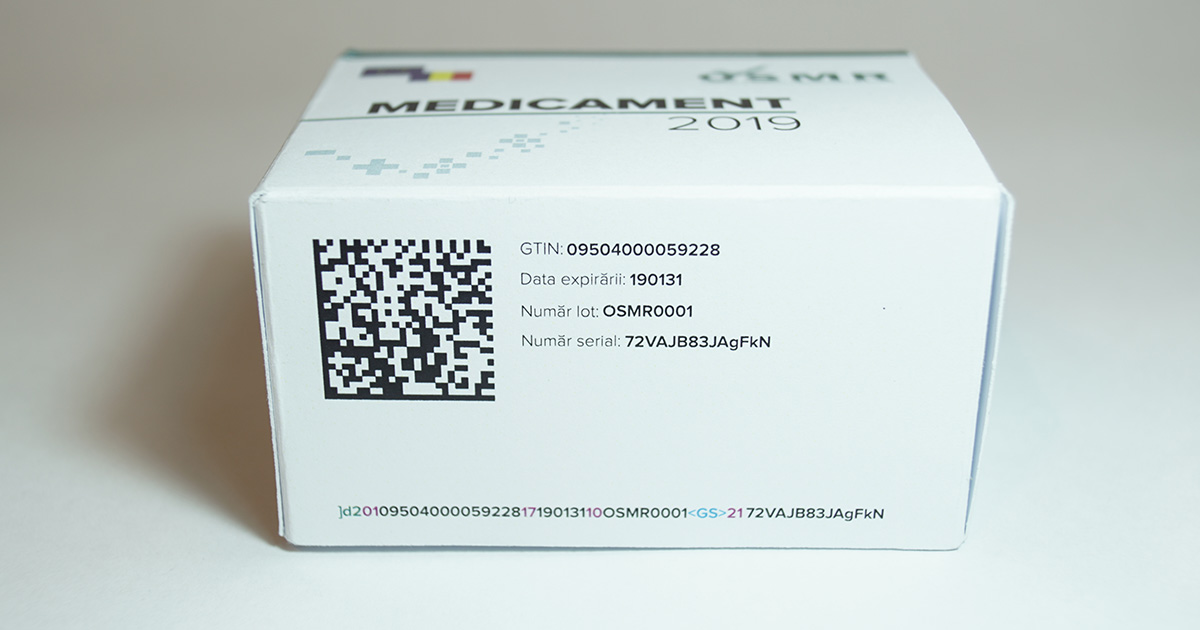
Începând cu 9 februarie 2019, acest tip de cod de bare va apărea pe toate cutiile de medicamente vândute în statele membre UE. Codul conține o serie de informații, precum data de expirare, numărul de lot și seria medicamentului. Aceste date vor fi scanate într-o manieră similară codurilor de bare folosite pentru produsele alimentare, pentru a verifica autenticitatea medicamentelor înainte ca acestea să ajungă la consumator.
În afară de codul de bare cu informațiile produsului, ambalajele medicamentelor vor fi dotate și cu un sigiliu care vor arăta dacă acestea au fost deschise înainte ca ele să intre în posesia consumatorului.
„Deținătorii autorizației de punere pe piață și producătorii sunt obligați să producă medicamentele vizate de noua legislație cu două elemente de siguranță care se verifică obligatoriu înainte de a fi eliberate către pacient: un identificator unic ce permite autentificarea ambalajului individual pe care acesta este imprimat și un dispozitiv de protecție împotriva modificărilor ilicite, ce permite verificarea integrității fizice a ambalajului și poate evidenţia orice tentativă de modificare ilicită a acestuia” – Alexandru Chetrușcă, Project Manager Arvato, compania care va fi responsabilă cu implementarea modulului național în România
Potrivit lui Alexandru Chetrușcă, implementarea sistemului național de verificare a medicamentelor presupune parcurgerea următorilor pași obligatorii:
- clarificarea reglementărilor naționale necesare producătorilor pentru a demara trecerea la noile ambalaje și pentru a asigura cu succes perioada de tranziție în piață la noile reguli
- introducerea prin intermediul Hub-ului european în modulul național a datelor despre medicamentele care vor fi eliberate pacienților români și clarificarea regulilor naționale necesare organizațiilor implicate în distribuția medicamentelor
- eliberarea medicamentelor către pacienți, pentru a cunoaște cine, când și cum trebuie să realizeze verificările în sistem și inspecțiile fizice ale ambalajelor

Dr. Diana Loreta Păun, consilier de stat la Administrația Prezidențială, a subliniat faptul că procesul de implementare a Sistemului Național de Verificare a Medicamentelor este cu atât mai important, în contextul în care România va deține în anul 2019 președinția Consiliului UE, ceea ce implică o și mai mare responsabilitate pentru țara noastră, care depășește spațiul local și se extinde la nivel european.
„Falsificarea medicamentelor reprezintă o amenințare majoră pentru sănătatea societății. Acest fenomen afectează atât medicamentele originale, cât și pe cele generice. Progresele tehnologice cresc potențialul de falsificare, dar pun la dispoziție și mijloacele necesare pentru împiedica falsificarea medicamentelor. Împiedicarea pătrunderii medicamentelor falsificate în lanțul de aprovizionare nu este posibil decât prin implementarea acelorași măsuri în toate statele membre UE” – dr. Diana Loreta Păun, Consilier de Stat în Departamentul de Sănătate Publică.
Potrivit lui Andreas Walter, director general al Organizației Europene de Verificare a Medicamentelor, în acest ultim an trebuie realizate legături între 2.300 de producători, din 32 de țări. De asemenea, trebuie serializate 10,5 miliarde de cutii de medicamente.
Organizația de Serializare a Medicamentelor (OSMR) a fost înființată în luna iulie a anului 2017 ca parte a procesului de implementare a Directivei 2011/62/CE. În viitorul apropiat, OSMR urmează să devină membru al Organizației Europene de Verificare a Medicamentelor (EMVO).
Anul trecut, un studiu efectuat de Organizația Mondială a Sănătății a arătat că 1 din 10 medicamente vândute în zonele cu venituri scăzute sau medii sunt falsificate sau nu respectă standardele de calitate. Din anul 2013, Sistemul Global de Supraveghere și Monitorizare OMS pentru produse medicale falsificate sau care nu respectă standardele de calitate a înregistrat peste 1.500 de rapoarte în legătură cu acest fenomen, 21% dintre ele provenind din Europa. În perioada 2013-2016, peste 400 de incidente de falsificare a medicamentelor au fost semnalate în UE.
Alte articole relevante:
De două ori mai multe medicamente noi au fost compensate în 2017, comparativ cu 2015, în România
2017 este anul cu cele mai multe medicamente aprobate la nivel mondial

