Simpozionul Anual de Studii Clinice 2020: impactul pandemiei COVID-19 asupra cercetării clinice și oportunități pentru viitor
Pandemia COVID-19 a avut un impact semnificativ asupra dezvoltării studiilor clinice, o etapă importantă din parcursul dezvoltării unei noi molecule care stă la baza unui medicament, dar și cea care oferă multiple beneficii pacienților, medicilor și bugetului statului. Simpozionul Anual de Studii Clinice, desfășurat online, pe 20 noiembrie, s-a concentrat asupra transformărilor aduse de pandemie asupra acestui domeniu, tema de anul acesta fiind: „2020 – Un an al provocărilor fără precedent în cercetarea clinică. Ce am învățat și cum putem transforma cele învățate în timpul pandemiei COVID-19 într-un avantaj pentru viitor?”.

Printre invitați s-au numărat reprezentanți ai autorităților de reglementare din România și din alte țări europene, reprezentanți ai industriei biofarmaceutice internaționale, specialiști în probleme de reglementare, KOL (key opinion leaders)/ investigatori medicali, reprezentanți ai CRO (Contract Research Organization) și ai asociațiilor de pacienți. Această ediție a fost organizată de AVANTYO Institute of Clinical Research sub patronajul EUCROF – Federația Europeană a Companiilor Conducătoare de Studii Clinice și ACCSCR – Asociația Companiilor Conducătoare de Studii Clinice din România.
„Simpozionul de Studii Clinice este unicul eveniment național cu participare internațională a comunității de specialiști în cercetare clinică din România, iar anul acesta și-a propus să creeze un cadru în care audiența să afle de la invitați de marcă despre modele de ultimă oră pe care să le urmeze și despre obstacole pe care să le evite în față pandemiei COVID-19 și nu numai, acum și în viitor,” a declarat Dr. Cristina Florescu Moraid.
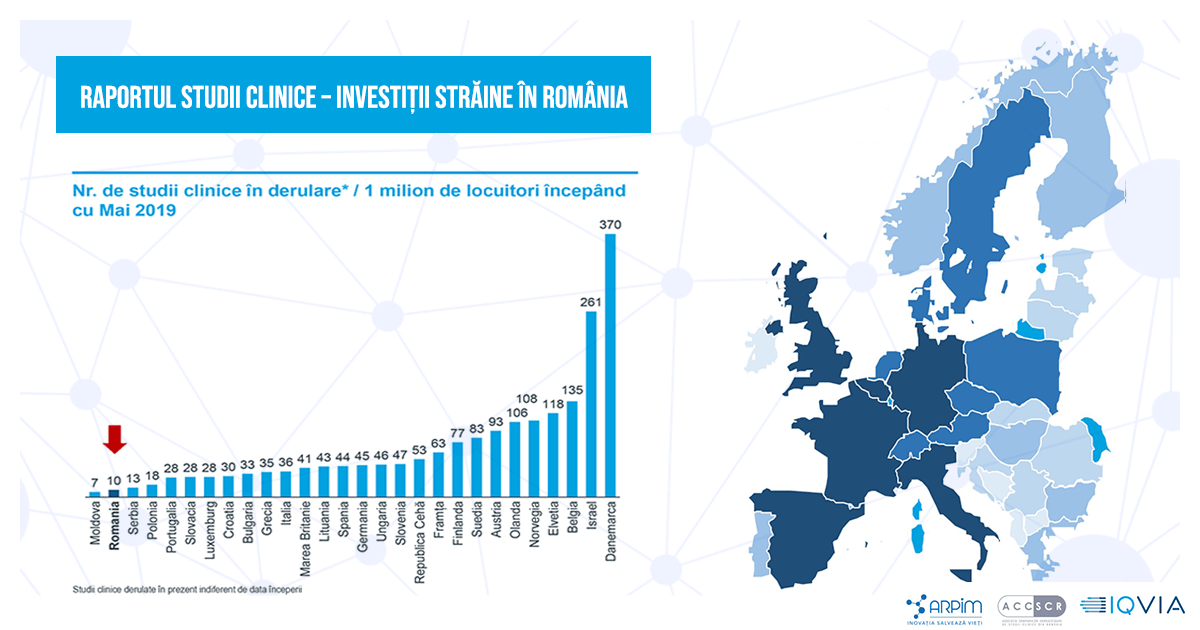
Reorganizarea Agenției Naționale a Medicamentului și Dispozitivelor Medicale din România (ANMDMR), prevăzută de Legea 134/08.2019, nu este pusă în aplicare nici după mai mult de un an de la publicarea cadrului legal. Dezbaterea pe acest subiect a întrunit reprezentanți ai autorităților de reglementare, ai mediului academic, ai industriei farmaceutice (ARPIM – Asociația Română a Producătorilor Internaționali de Medicamente) și ai companiilor conducătoare de studii clinice (ACCSCR). Discuțiile au pornit de la date concludente din raportul privind situația studiilor clinice realizate de IQVIA România la solicitarea ARPIM și ACCSCR și prezentat publicului în septembrie 2020.
În calitate de autoritate de reglementare, ANMDMR nu a oferit răspunsuri clare și cuantificabile legate de pașii pe care îi va face pentru a scurta perioada de aprobare a studiilor clinice, ce depășește, în medie, cu mult cele 60 de zile prevăzute în lege, și nici un punct de vedere referitor la strategia adecvată din partea noii conduceri a agenției.
Astfel, s-a ajuns la concluzia că este nevoie de mai multă transparență și comunicare din partea reprezentanților ANMDMR față de pacienți, medici investigatori, companii conducătoare de studii clinice (CRO) și reprezentanții sponsorilor (industria farmaceutică). Pentru rezolvarea status-quo-ului din agenție, toți ceilalți reprezentanți ai părților implicate în studii clinice (universitari, Comisia de Bioetică, sponsorii prin ARPIM și CRO-urile prin ACCSCR) și-au arătat disponibilitatea de a contribui, în limitele legii, la dezamorsarea situației.
Impactul epidemiologic al COVID-19 în România și Europa
Conform reprezentanților mediului academic și ai site-urilor de desfășurare a studiilor (centrele investigaționale – centre medicale și spitale), comunitatea de cercetare clinică s-a confruntat cu multe provocări din martie până în prezent, deoarece multe studii au fost închise sau amânate. În studiile oncologice, chiar și pacienților negativi sau COVID-19 asimptomatici li s-a limitat accesul la site, acolo unde primesc medicația de studiu și sunt urmăriți. Au existat numeroase întârzieri în ceea ce privește livrarea medicației de studiu către pacienți și site.
„Am aflat că în alte țări europene s-au folosit cu succes serviciile de tip Direct-to-Patient sau Home Care, soluții care sperăm să fie folosite și în România cât mai mult, fiind foarte bine adaptate pentru această perioadă în care trebuie evitată expunerea pacientiilor în spitale”, a menționat Dr. Cristina Florescu Moraid.
Reprezentanții CRO și a două mari companii farmaceutice internaționale au precizat că există o teamă reală și legitimă, la nivel mondial, în legătură cu vizita pacienților la spital/site. Mai mult, aceștia au adăugat faptul că se confruntă cu provocări legate de monitorizarea siguranței pentru echipa de studii clinice.
Rezultatul proiectul “PARADIGM – cadrul de guvernanță multi-stakeholder pentru implicarea pacienților din Europa”, subliniază că, pentru a crește accesul pacienților la cercetarea clinică, trebuie identificat pacientul potrivit pentru studiul potrivit, prin folosirea ghidului de practică elaborat de Paradigm și a instrumentelor oferite de acest proiect. De asemenea, atât pacienții cât și opinia publică au dreptul să afle într-o manieră mult mai transparentă care sunt rezultatele unui studiu clinic, cum se abordează un studiu clinic, care este patologia vizată etc.
Regulamentul European de Desfășurarea a Studiilor Clinice 536/2014 va intra în vigoare în 2021, dar nu va putea fi pus în aplicare fără implementarea corectă a CTIS, Sistemul Informatic pentru Studii Clinice, dezvoltat de Agenția Europeană a Medicamentului (EMA).
„Analizând cele spuse în mai multe sesiuni ale simpozionului, putem concluziona că trebuie folosite cele mai noi modalități de desfășurare a studiilor în mai mare siguranță, atât pentru pacienți, cât și pentru echipe, iar noile tehnologii ne oferă această posibilitate. Ghidurile și protocoalele existente trebuie să fie puse în aplicare, iar legea să fie respectată. Ritmul de adaptare la noul Regulament European de Desfășurarea a Studiilor Clinice nr. 536/2014 care intră în vigoare în 2021 trebuie să fie mai accelerat, inclusiv la noi în țară”, a afirmat Dr. Cristina Florescu Moraid.
Prof Dr. Adrian Streinu-Cercel, Director al Institutului de Boli Infecțioase “Prof. Dr. Matei Balș” din București, subliniază faptul că, în condițiile în care SARS-CoV-2 acumulează, conform studiilor, aproximativ două mutații în fiecare lună, trebuie să fim pregătiți să testăm mai mult și să găsim soluții pentru a ne întoarce la viața noastră normală până când tratamentul va fi disponibil.
Înrolarea pacienților în studii clinice în timpul pandemiei COVID-19
În urma discuțiilor din cadrul dezbaterii la care au fost invitați reprezentanți ai asociațiilor de pacienți s-a ajuns la concluzia că soluția ar fi implementarea ghidurilor, dând astfel pacienților posibilitatea de a fi recrutați și de a avea o șansă la medicație de ultima oră. În România, dar și în alte țări precum Polonia, deși au fost depuse eforturi în crearea de ghiduri pentru continuarea activităților, acestea nu au fost puse în aplicare.
„Referitor strict la România, unde există o comunitate de profesioniști foarte bine pregătiți, dacă țară noastră s-ar alinia la performanța celor mai eficiente țări, potențialul ar fi de 10-20 ori mai mare decât acum și am ajunge ca piața noastră de studii clinice să depășească 800 mil EUR. Putem spune că viitorul studiilor clinice depinde de felul în care ANMDMR își va transforma activitatea conform legii 134/08.2019” – Dr. Cristina Florescu Moraid.
„Îmbunătățirea activității agenției, cu efect în reducerea perioadei de aprobare a studiilor clinice, înseamnă ca pacienții noștri să beneficieze de tratament și îngrijire superioare celor oferite prin asigurarea medicală de stat, medicii să lucreze în proiecte de cercetare internațională cu descoperiri de ultima oră, Casă Națională de Asigurări să fie degrevată de cheltuieli de sute de mii de euro anual, iar la bugetul statului să se încaseze sume importante care ar putea ajunge la milioane de euro”, a mai adăugat Dr. Cristina Florescu Moraid.
Studiile clinice în România
Reprezentanții industriei de studii clinice din România sunt preocupați de readucerea României pe harta internațională de interes pentru studii clinice cu beneficii reale de dezvoltare pentru medici, șanse la tratamente inovative pentru pacienți și sume importante la buget.
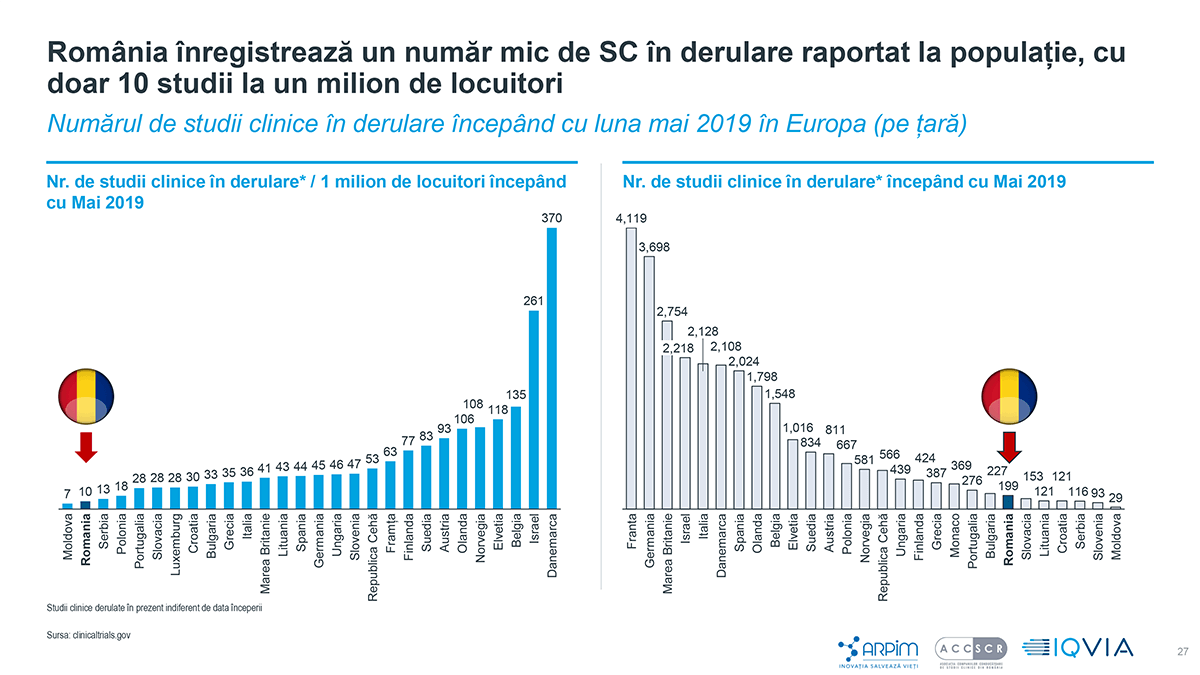
Potrivit raportului intitulat Studii Clinice – Investiții Străine în România, țara noastră înregistrează un număr mic de studii clinice în derulare raportat la populație, cu 163 de studii aprobate în 2019 și cu doar 10 studii la un milion de locuitori, ocupând penultimul loc în ierarhia europeană. Numărul de studii clinice efectuate în 2019 (98) situează România în urma țărilor vecine, Bulgaria (108) și Ungaria (207).
Citește și:
- Simpozionul Anual de Studii Clinice 2019: cum accelerăm accesul la terapii moderne
- Raportul “Studii Clinice – investiții străine în România: doar studii clinice la 1 milion de locuitori se află în derulare începând cu mai 2019”
- Raportul IQVIA „Evaluarea inovațiilor terapeutice centrate pe pacient”. ARPIM face apel pentru includerea experienței pacientului în procesul de evaluare a tehnologiilor medicale

