STUDIU. 1 din 17 pacienți cu boală cardiovasculară aterosclerotică prezintă o afecțiune genetică: hipercolesterolemie familială. În peste 90% dintre țările de pe glob nu se cunoaște prevalența HF
De ce infarctul miocardic apare și la o persoană tânără? De ce tratamentul cu statine nu funcționează la fel de bine pentru toți pacienții cu boală aterosclerotică? De ce o persoană cu un stil de viață sănătos are valori crescute ale LDL-colesterolului? Științele „omice” ne demonstrează în ultimii ani că pentru aceste întrebări pot exista mai multe răspunsuri. Cu toate acestea, un răspuns adesea ignorat este: hipercolesterolemia familială (HF), o boală genetică, ce reprezintă principala cauză de infarct miocardic la o persoană tânără. În forma heterozigotă, constituie una dintre cele mai frecvente boli monogenice.
O meta-analiză asupra prevalenței hipercolesterolemiei familiale heterozigote (HeHF) a fost publicată recent în Circulation. 62 de studii au fost evaluate, care au inclus în total 7,3 milioane de persoane. Prevalența HeHF este de 1:311 în populația generală. 1 din 17 pacienți cu boală cardiovasculară aterosclerotică suferă de fapt, de o boală genetică: hipercolesterolemie familială. Prevalența e similară în toate regiunile OMS evaluate. Studiul aduce informații importante pentru strategiile de sănătate publică, susținând utilitatea screening-ului pentru detecția precoce a persoanelor cu HF.
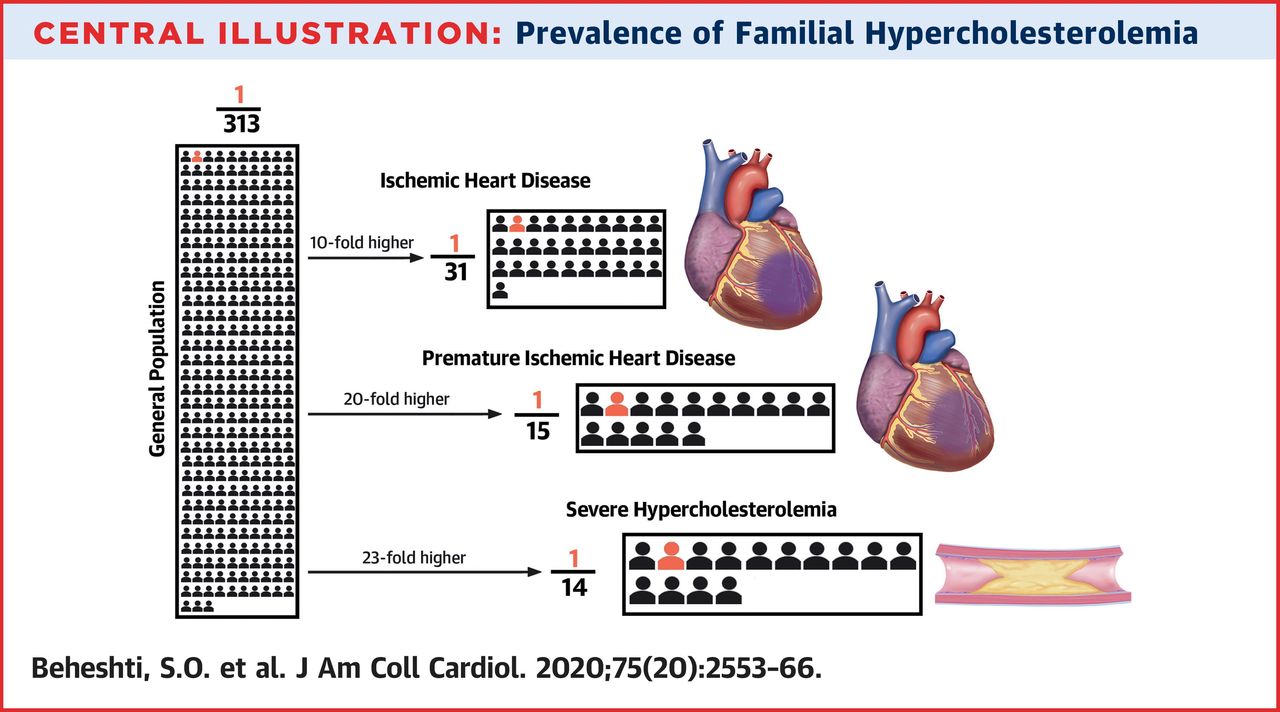
Cea mai mare meta-analiză de până acum, publicată în Journal of the American College of Cardiology (JACC) confirmă prevalența ridicată a HF în populația generală, datele fiind similare, 1:313. Lucrarea a cuprins o evaluare a 11 milioane de persoane din 104 țări și oferă rezultate detaliate și asupra unor subgrupuri țintă de pacienți cu boli cardiovasculare. De exemplu, 1 din 15 pacienți cu boală cardiacă ischemică are HF. Un alt semnal de alarmă este faptul că în doar 9% dintre țările din întreaga lume se cunoaște prevalența HF.
Aceste cercetări reprezintă sinteze ale datelor acumulate la nivel global și arată că HF este mai frecventă decât se credea și afectează la fel de mult oameni din diferite țări de pe glob. Mesajul comun este că reprezintă o problemă de sănătate publică ce nu mai poate fi ignorată. De asemenea, autorii atrag atenția asupra importanței screeningului, rolul testării genetice și rolul tratamentelor instituite precoce, având în vederea creșterea opțiunilor terapeutice în ultimii ani.
În forma heterozigotă, HF reprezintă una dintre cele mai frecvente boli monogenice, însă de-a lungul timpului au existat variații legate de raportarea prevalenței bolii. Înainte de anii 2000, prevalența era aproximată la 1:400- 1:500. În ultimii ani, aceasta a crescut, fiind statistici care raportează o prevalență de 1:200 – 1:250, în America de Nord și Europa. Forma homozigotă este mult mai rară, afectează o persoană dintr-un milion și nu reprezintă obiectul studiilor menționate anterior.
Până la vârsta de 10 ani, copiii cu HF netratați au deja leziuni aortice și prezintă îngroșarea peretelui carotidelor. Plăcile de aterom pot fi identificate la un sfert dintre adolescenții cu HF. Mai puțin de 10% dintre cazurile de HF sunt diagnosticate, la nivel global.
Lucrarea publicată în Circulation a inclus 42 de studii asupra prevalenței HF în populația generală. S-au identificat peste 24.000 de pacienți cu HeHF, dintre 7.297.363 subiecți. Alte 20 de studii au luat în considerare categoriile de pacienți cu boală cardiovasculară aterosclerotică (2.827 de pacienți din 48.208 de participanți). Datele au inclus o proporție mică din populația asiatică și africană.
- Prevalența HeHF în populația generală a fost de 1:311, rezultatele fiind similare pentru majoritatea subgrupurilor. În populația adultă prevalența a fost de 1:303;
- Prevalența bolii cardiovasculare aterosclerotice premature este de 18 ori mai mare în rândul pacienților cu HeHF decât în populația generală.
Prevalența HeHF în subgrupuri țintă: o meta-analiză a 11 milioane de pacienți
O altă meta-analiză, publicată la finalul lunii mai în JACC, a reunit 104 studii, 11 milioane de persoane evaluate în total, dintre care peste 37.000 de pacienți cu HF. Această lucrare a inclus și populații neacoperite de meta-analiza anterioară, precum persoane din Africa de Sud. Prevalența HF în populația generală a fost de 1:313, datele fiind bazate în mare parte pe criterii clinice de diagnostic. Un obiectiv important a fost caracterizarea prevalenței HF în 3 grupuri țintă de pacienți cu BCV:
- Comparativ cu populația generală, prevalența HF a fost de 10 ori mai mare în cazul persoanelor cu boală cardiacă ischemică (1:31), de 20 de ori mai mare în cazul celor cu boală cardiacă ischemică prematură (1:15) și de 23 de ori mai mare (1:14) în cazul celor cu hipercolesterolemie severă;
- 17 din 195 de țări au raportat prevalența HF în populația generală. Cele mai multe studii provin din Europa, America de Nord, Asia de Est și Australia.
- În 178 de țări (91%) nu se cunoaște această prevalență. Autorii atrag atenția că sunt multe zone de pe glob pentru care nu există date: mare parte din Africa, Asia de Sud-Est și mare parte din America de Sud.
Redefinirea bolii: HF este doar vârful icebergului?
Determinarea prevalenței HeHF este asociată cu o mare variabilitate. Autorii studiului publicat în Circulation consideră că motivul este reprezentat de diferențele legate de modul în care este definită hipercolesterolemia familială.
Unul dintre cele mai frecvente scoruri folosite în clinică pentru diagnosticarea bolii este Dutch Lipid Network Criteria, care include testarea LDL-colesterolului în sânge, examinarea fizică, istoricul familial și datele genetice, dacă sunt disponibile. Criteriul genetic nu este necesar pentru stabilirea diagnosticului. Alte instrumente de diagnostic sunt Simon Broome Criteria (care folosește date clinice și genetice) și MED-PED (care nu include testarea genetică). Cele trei criterii de diagnostic au fost comparate între ele și nu s-a putut demonstra superioritatea uneia. Atunci când pacienții cu un diagnostic clar de HF au fost testați genetic s-a observat că detectarea mutațiilor a fost scăzută: 30-40%. Rezultatele sugerează că e posibil ca nu toate mutațiile să fie testate sau că s-a trecut cu vederea componenta poligenică.
Toate aceste scoruri sunt utile pentru identificarea persoanelor la risc pentru dezvoltarea de boală aterosclerotică. Majoritatea celor care îndeplinesc criteriile clinice pentru HF, însă, nu au și un test care să valideze o anumită mutație.
Într-un editorial care a însoțit publicarea articolului din Circulation se atrage atenția asupra faptului că toate aceste aspecte trebuie luate în considerare în realizarea strategiilor pentru sănătate publică. Autorii au explicat faptul că pacienții cu HF reprezintă doar „vârful icebergului” pentru o categorie de pacienți mult mai amplă, cu hipercolesterolemie severă, pentru care trebuie să existe un management adecvat al riscului de boală cardiovasculară aterosclerotică – screening, dar și intervenție precoce. Editorialul cuprinde și o propunere de actualizare a clasificării pacienților cu hipercolesterolemie, în 4 grupuri, în funcție de 2 elemente cheie – prezența sau absența unei variante genetice patologice și prezența sau absența hipercolesterolemiei severe (definită printr-o valoare LDL-c mai mare de 190 mg/dl). Ar exista astfel, 4 situații:
- Persoane care au o anomalie genetică detectabilă și hipercolesterolemie severă. Aceștia se încadrează la categoria „clasică”, cunoscută sub denumirea de HF. Prezența mutației genetice recomandă și realizarea screeningului în cascadă. De asemenea, cunoaștere genotipului poate crește aderența la tratamentul inițiat precoce pentru scăderea LDL-colesterolului;
- Hipercolesterolemie severă, dar fără o anomalie genetică identificată. Aceste cazuri au o prevalență de 1/20 în populație. Mulți dintre acești pacienți nu sunt testați. Atunci când există un test genetic, rezultatul poate fi negativ fie pentru că există o variantă rară într-o genă cunoscută sau există o variantă la nivelul unei gene necunoscute. De asemenea, tot mai multe dovezi susțin și caracterul poligenic al unelor forme de boală. Screeningul (teste biochimice) rudelor apropiate ar fi recomandat și în acest caz;
- Există o mutație, dar nu se manifestă fenotipic. La acești pacienți nu apare expresia clinică de hipercolesterolemie severă. Factorii sunt, și în aceste situații, variabili – factori care țin de penetranța variantelor genetice, existența unor gene necunoscute, componenta poligenică sau doar stilul de viață. Totuși riscul pacienților se menține, deoarece poate exista expunerea pe termen lung la niveluri ridicate de LDL-colesterol. Profilul lipidic ar trebui monitorizat periodic și tratamentul adaptat în funcție de caz. Screeningul, fie prin test genetic sau biochimic se recomandă și în aceste cazuri;
- Nu există nici anomalii genetice detectate, nici hipercolesterolemie severă. Recomandările pentru screening și tratament trebuie adaptate în funcție de ghidurile naționale.
Hipercolesterolemia familială heterozigotă, la fel de frecventă ca diabetul zaharat de tip 1
Medicul norvegian Carl Muller descria în 1930 asocierea dintre boala cardiovasculară, prezența xantoamelor tendinoase și hipercolesterolemie. Acesta a descris componenta ereditară și posibilele implicații pentru prevenție. A fost nevoie însă de încă 50 de ani pentru a se recunoaște relevanța practică a acestor observații.
În 1973, Joseph L. Goldstein și Michael S. Brown identificau receptorul pentru LDL-colesterol, descoperire pentru care 13 ani mai târziu primesc premiul Nobel pentru Medicină. Cercetările acestora au pornit de la studiul HF. Conform comunicatului oficial din 1986: „au descoperit că mecanismul responsabil de apariția hipercolesterolemiei familiale severe este absența sau prezența insuficientă a receptorilor LDL funcționali”, ceea ce a condus la „noi principii pentru tratamentul și prevenția aterosclerozei”.
HF este o boală genetică autozomal dominantă, primele descrise fiind mutațiile genei care codifică receptorul pentru LDL-colesterol, ceea ce determină afectarea procesării hepatice a particulelor LDL circulante. Ulterior, și alte gene au fost identificate – APOB (apolipoproteina B) și PCSK9 (proprotein convertase subtilisin/kexin type 9).
După 2003, medicina a intrat într-o nouă etapă, cea a genomicii, în care chiar modelul clasic al bolilor monogenice, rare, este redefinit. Strategiile ample de screening își demonstrează fezabilitatea. De asemenea, datorită noilor tehnici de secvențiere genetică, s-a descoperit că, în 20-40% dintre cazuri, boala are o cauză poligenică. Testarea genomică își dovedește tot mai multe aplicații. Poate explica, de exemplu, heterogenitatea fenotipurilor întâlnite. Pacienții cu HF heterozigotă severă pot avea valori ridicate ale LDL-colesterolului care se suprapun peste cele întâlnite în HF homozigotă. În formele homozigote însă, apare adesea situația unei mutații care determină absența receptorului LDL. În aceste cazuri, tratamentul cu statine ar fi ineficient.
Recunoașterea impactului HF
La începutul anului 2020, FH Foundation și World Heart Federation au lansat un apel pentru recunoașterea poverii globale a hipercolesterolemiei familiale la care au colaborat reprezentanți din 40 de țări. Cu această ocazie, s-a actualizat raportul pentru HF emis de Organizația Mondială a Sănătății în 1998 și noile recomandări au fost publicate în JAMA Cardiology.
O mare parte dintre persoanele care suferă de HF nu sunt diagnosticate. Date prezentate în cadrul FH Global Summit din 2019 arată că gradul de informare asupra bolii este scăzut la nivel de asistență medicală primară. 15% dintre medicii de familie sunt informați asupra subiectului, pe când 61% dintre cardiologi cunosc implicațiile bolii. De asemenea, gradul de informare asupra utilității screeningului este scăzut și în cazul pediatrilor.
Un studiu prezentat în cadrul Congresului EAS, în 2019, arăta că pentru o persoană care nu e diagnosticată până la 18 ani, speranța de viață scade cu 16 ani. Rezultatele confirmă rolul screening-ului inițiat precoce, înainte de vârsta de 20 de ani.
Screeningul în cascadă este recomandat de principalele organizații la nivel mondial – World Health Organisation (WHO), American Heart Association (AHA), Centers for Disease Control and Prevention (CDC). Conform datelor din registrul CASCADE-FH, testarea genetică se realizează în puține cazuri. Dintre 4.176 de pacienți, doar 10,7% au fost testați pentru determinarea anomaliilor genetice. De asemenea, diagnosticul HF se realizează tardiv, în jurul vârstei de 48 de ani, iar tratamentul cu statine nu este inițiat timpuriu.
Mai multe opțiuni terapeutice pentru controlul LDL-c
Trei clase de medicamente folosite în mod curent în practică au fost dezvoltate inițial pentru tratamentul persoanelor cu HF – statinele, ezetimib-ul și inhibitorii PCSK9.
Statinele reprezintă tratamentul standard, toate ghidurile internaționale recomandă ca tratament de primă linie cu scopul de atingere a dozei maxime tolerate. Cele mai multe studii randomizate arată o reducere cu 50% a valorilor LDL-colesterolului, precum și reducerea evenimentelor cardiovasculare. Date din registrul britanic Simon Broome arată că de la introducerea statinelor, s-a obținut o reducere a mortalității de cauză coronariană cu mai mult de o treime.
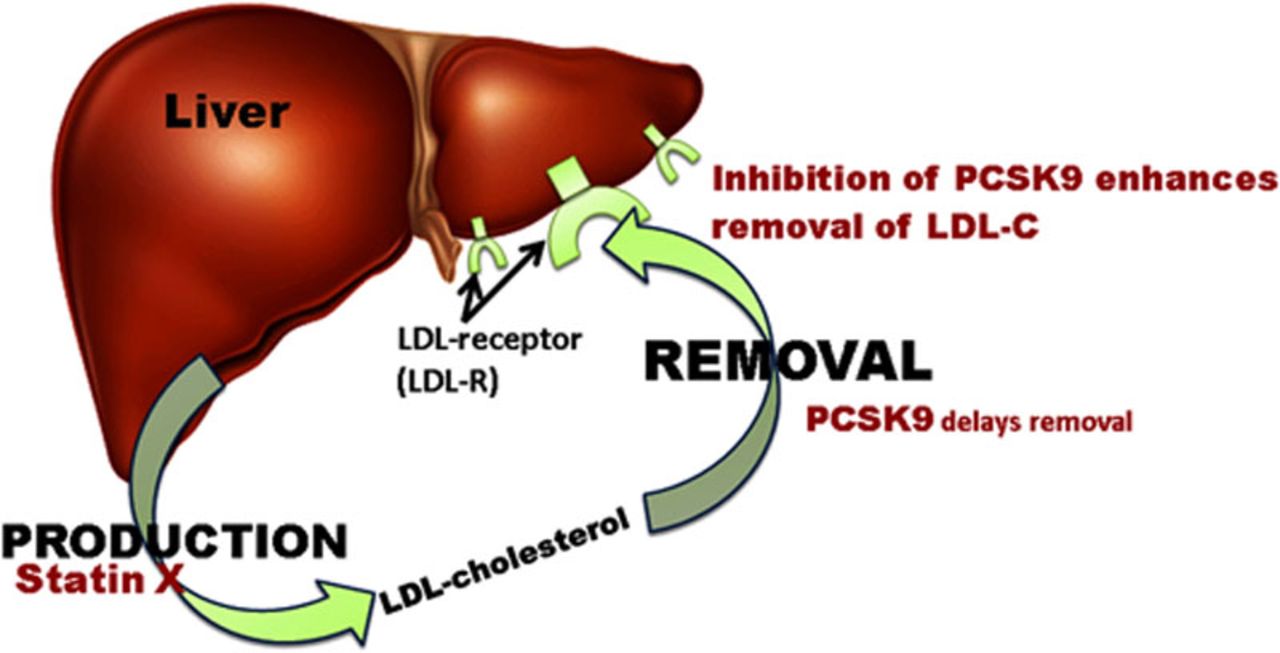
Cu toate acestea, mulți pacienți nu obțin un control bun al nivelului LDL-colesterolului. Terapiile de linia II includ ezetimib, care permite obținerea unei reduceri de până la 30% a LDL-c și inhibitorii PCSK-9, care pot reduce LDL-c cu 50-60%.
Inclisiran este un nou tip de tratament, din categoria oligonucleotidelor antisens, care permite țintirea unor regiuni specifice de la nivelul ARN care codifică proteine implicate în metabolismul lipidic. Reprezintă o terapie care se administrează de doar 2 ori pe an (față de 12 și 26 de injecții pe an care sunt necesare pentru administrarea anticorpilor monoclonali). Date recente sugerează că poate reduce LDL-colesterolul cu 50% în doar două săptămâni. În Regatul Unit, 40.000 de pacienți vor primi inclisiran, în cadrul unu studiu pentru evaluarea tratamentului în prevenția primară a bolilor cardiovasculare.
Citește și:
- FH Global Call to Action: Apel internațional pentru noi strategii în controlul hipercolesterolemiei familiale. Care sunt recomandările experților?
- Campania #JustGo: Pacienții cu urgențe cardiovasculare trebuie să solicite ajutor medical fără întârziere în această perioadă. Riscul de deces din cauza unui infarct miocardic netratat este 10 ori mai mare decât cel din cauza COVID-19


