STUDIU. Prin testare comprehensivă genomică pot fi identificate mutații acționabile la 80% din pacienții cu cancere avansate
Un studiu publicat în JAMA Oncology a urmărit identificarea categoriilor de pacienți oncologici care obțin cele mai mari beneficii în urma testării comprehensive genomice. Prin testare NGS (secvențierea întregului exom sau a unui panel extins de gene) s-au identificat anomalii acționabile pentru 4 din 5 pacienți cu tumori avansate. Pentru pacienții cu cancere de origine primară necunoscută (CUP – carcinoma of unknown primary origin), a fost posibilă identificarea țesutului de origine în peste jumătate din cazuri. Rezultatele au implicații și pentru evaluarea riscului de cancer la membrii familiei, având în vedere că 16% dintre pacienți aveau variante patologice la nivelul liniei germinale (PGV – pathogenic germline variants).
Doar 10-25% dintre pacienții cu tumori avansate primesc un tratament informat de datele obținute prin secvențiere, de aceea este dificil să se estimeze beneficiul clinic pe care acești pacienți îl obțin în urma testării NGS. Studiile care au evaluat impactul testării comprehensive NGS pentru pacienții cu cancere avansate raportează o gamă largă de mutații acționabile clinic per pacient, care variază între 40-94%. Studiul publicat în JAMA cuprinde o analiză a prognosticului clinic al pacienților cu tumori solide avansate, care au primit testare NGS și oferă o perspectivă importantă asupra utilității clinice a unei astfel de abordări.
Rezultatele susțin două direcții majore care ar putea fi implementate în practică:
- Testarea liniei germinale la toți pacienții cu cancere avansate;
- Utilizarea testării genomice comprehensive ca parte din abordarea standard a pacienților cu cancere de origine necunoscută și alte neoplasme rare;
Testarea prin Mi-ONCOSEQ
Studiul a urmărit 1.015 pacienți care au participat în programul Michigan Oncology Sequencing (Mi-ONCOSEQ), în perioada 2011-2018. Până în prezent, în cadrul programului au fost incluși peste 3.500 de pacienți. S-au prelevat probe de la nivel tumoral și din sângele pacienților pentru realizarea profilului genomic tumoral și analiza ADN-ului celulelor normale. Probele au fost prelucrate prin analiza întregului exom sau testare țintită a unui panel de 1.700 de gene și secvențiere ARN.
Un comitet multidisciplinar (tumor board) a interpretat lunar datele obținute prin secvențiere. Rezultatele au fost prezentate oncologului care îngrijește pacientul, într-un raport generat după 4-6 săptămâni de la înrolare. Tratamentul ghidat de NGS putea fi administrat on/ off label sau în contextul unui studiu clinic, în funcție de decizia oncologului. Modificările genomice au fost clasificate în funcție de nivelul de dovezi existente și relevanța clinică. Modificările genomice de clasa 1 și 2 erau considerate acționabile clinic.
Dintre anomaliile moleculare din clasele 1 și 2, 94% au fost identificate prin secvențiere ADN, iar 645 prin secvențiere ARN. Secvențierea ARN s-a dovedit esențială pentru identificarea a 103 modificări acționabile, mai ales permițând identificarea de fuziuni genice, dar și oferind informații importante privind influența unor infecții virale și markeri pentru CUP sau modificarea diagnosticului.
Rezultate
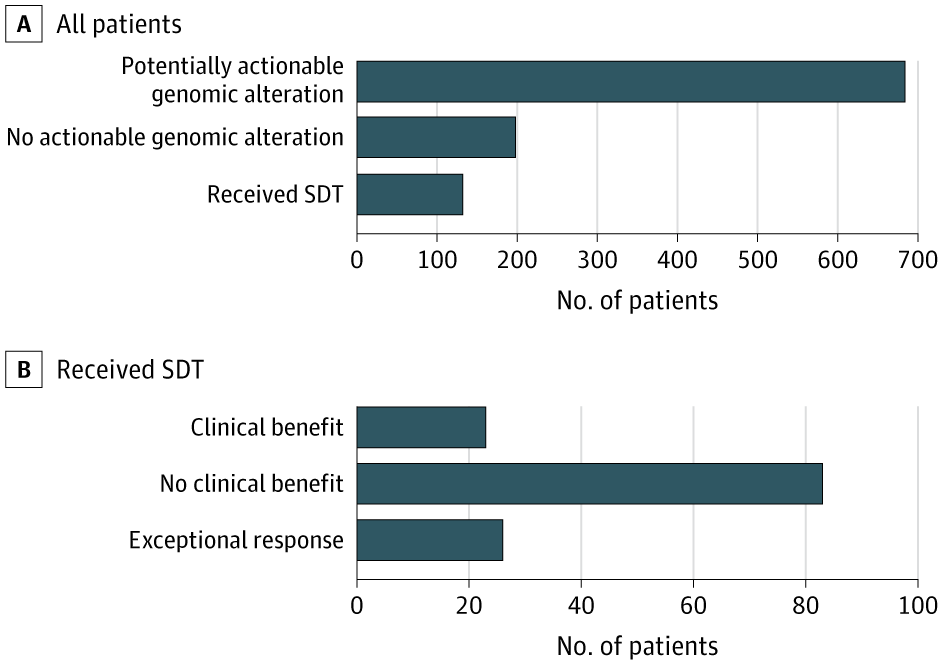
În urma testării NGS, pentru 80,5% dintre cazuri s-au identificat modificări genomice acționabile. Dintre aceste cazuri, 16,2% au primit terapie ghidată direct de secvențiere (SDT – sequencing directed therapy). Cele mai frecvente tipuri de cancere care au beneficiat de SDT au fost sarcoamele, adenocarcinomul de prostată și cancerele de origine primară necunoscută. Terapiile administrate pacienților au inclus inhibitori CDK4/6, inhibitori PARP, inhibitori FGF, inhibitori ai punctelor de control, terapie hormonală.
19,7% dintre pacienții care au primit SDT au prezentat un răspuns excepțional la tratament. Aceștia au fost tratați 12 luni sau mai mult (până la 39,5 luni). Modificările genomice identificate la cei cu răspuns excepțional au inclus defecte de reparare ADN (BRCA1/BRCA2, MSH2), amplificări la nivelul căii CDK4/6, amplificări ERBB2. 3 pacienți care au primit inhibitori ai punctelor de control pe baza unei încărcături tumorale ridicate (printr-un mecanism diferit de instabilitatea microsatelitară) au obținut un răspuns complet și nu mai au semne de boală.
„Am identificat un grup de pacienți cu neoplasme avansate și fără opțiuni terapeutice care au obținut controlul bolii pentru un an sau mai mult” – Dr. Erin Cobain, Michigan Medicine
Unul dintre cele mai importante rezultate ale studiul este legat de identificarea unor variante asociate cancerelor ereditare. Variante patologice la nivelul liniei germinale s-au identificat la 160 (15,8%) dintre pacienți, inclusiv 49 cazuri de PGV relevante din punct de vedere terapeutic. Cele mai multe PGV erau necunoscute înainte de înrolarea în MiONCOSEQ. 115 PGV erau sugestive pentru sindroame asociate cu o predispoziție pentru cancer cu penetranță moderată sau înaltă.
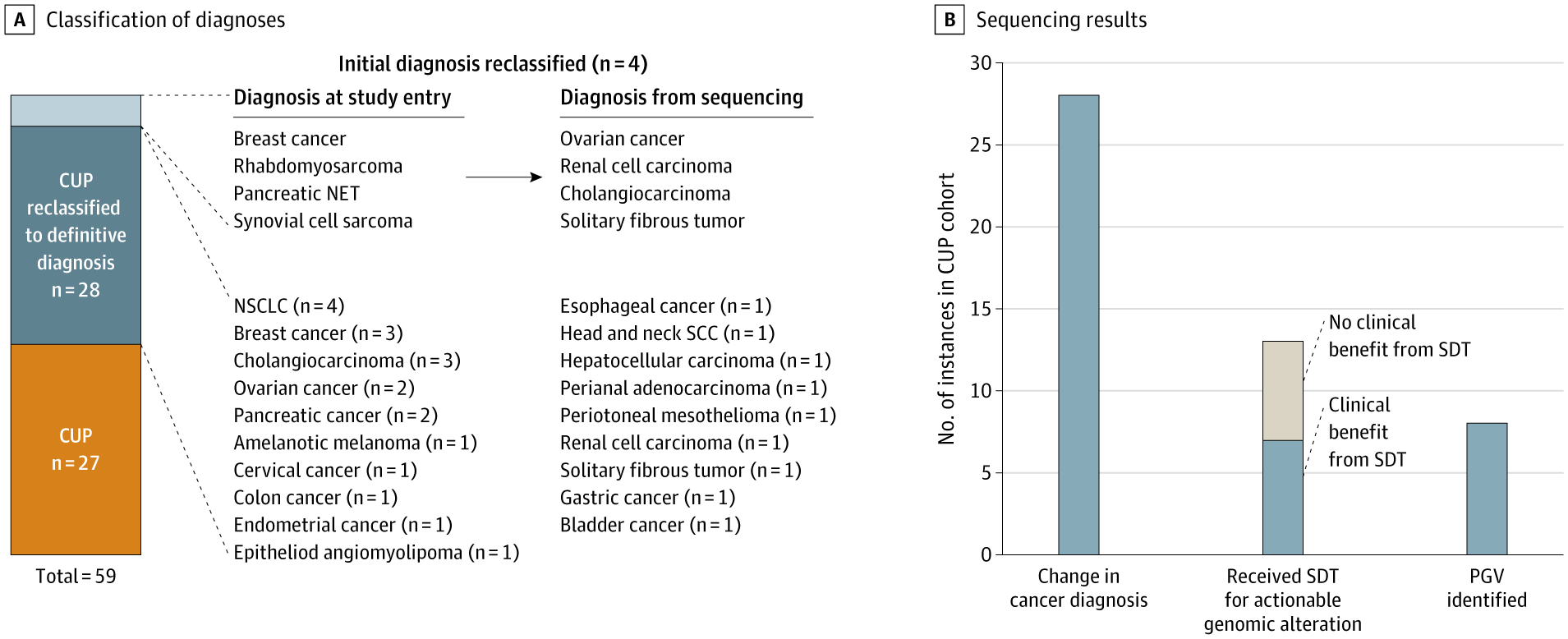
Pentru cancere de origine primară necunoscută, nu există în prezent o conduită terapeutică standard. Înainte de testarea NGS, 55 de pacienți aveau un diagnostic de CUP. În urma testării, 50,9% dintre cazuri au fost au fost reclasificate, fiind încadrate într-un diagnostic specific de cancer, ceea ce a permis identificarea unei terapii optime.
- Pentru 28 din 55 de pacienți cu carcinom de origine primară necunoscută, testarea comprehensivă prin NGS a permis identificarea originii tumorale;
- La 13 dintre acești pacienți s-a administrat o terapie ghidată de datele obținute prin secvențiere. 5 au avut răspunsuri excepționale iar 7 au avut un beneficiu clinic evident;
- S-au identificat PGV la 8 pacienți, în 4 cazuri acestea fiind acționabile terapeutic (BRCA1 la 2 pacienți, BRCA2 la 1 pacient și MSH2 la 1 pacient).
Utilitatea clinică a testării prin NGS
Rezultatele studiului susțin recomandarea pentru testarea tuturor pacienților cu tumori solide metastatice pentru identificarea unor anomalii la nivelul liniei germinale (mai ales genele implicate în repararea ADN), precum și testarea NGS de rutină pentru pacienții cu cancere de origine necunoscută și alte cancere rare. Prin descoperirea de biomarkeri genetici care pot ghida terapia antineoplazică se anticipează o creștere a aplicabilității clinice a acestei tehnologii.
Mai mult decât atât, rezultatele au implicații și pentru membrii familiei acestor pacienți, cărora li se poate recomanda testare genetică și pot fi urmăriți în cazul în care se identifică o variantă patologică a liniei germinale.
În prezent, testele care cuprind un panel de gene restrâns se folosesc mai frecvent decât testarea întregului genom/exom, datorită costurilor reduse, accesibilității dar și pentru limitarea unui volum de informație care nu este relevantă din punct de vedere clinic. Secvențierea întregului genom, sau a unui panel mult mai mare de biomarkeri face diferența atunci când se discută de atingerea potențialului medicinei de precizie în oncologie. Testarea comprehensivă permite identificarea de noi opțiuni terapeutice, mai ales în cazurile de neoplasme pentru care nu există standarde clare de tratament, cum este cazul CUP. Nu toate rapoartele obținute în urma acestor testări comprehensive sunt însoțite și de o interpretare a datelor acționabile. În acest context, studiul prezentat anterior aduce o perspectivă importantă asupra utilității acestui tip de testare genomică extinsă la pacienții cu neoplasme avansate.
Citește și:
- #BiotechWeek2020. Cum a evoluat domeniul genomicii și care sunt aplicațiile în practica medicală?
- #DecodămCancerul. De la descifrarea genomului uman la descifrarea genomului cancerului: răspunsurile și provocările pe care medicina genomică le aduce în oncologie

