FDA aprobă avapritinib, prima terapie țintită pentru tumorile stromale gastrointestinale (GIST), la pacienții care prezintă o mutație genetică rară
Administrația Alimentelor și Medicamentelor SUA (FDA) a aprobat avapritinib (denumire comercială Ayvakit) pentru tratamentul tumorilor stromale gastrointestinale (GIST) nerezecabile, care prezintă mutații ex 18 PDGFRA (la nivelul exonului 18 din cadrul genei care codifică receptorul A pentru factorul de creștere derivat din plachete sangvine). Această aprobare vine în urma declarării avapritinib medicament orfan și declanșării procedurii accelerate de aprobare.
“Avapritinib reprezintă un nou standard terapeutic pentru pacienții cu GIST, care prezintă mutații ex 18 PDGFRA, un grup care, până acum, a avut foarte puține opțiuni terapeutice. Din acest moment putem oferi un tratament deosebit de eficient și țintit pe cauza genetică a acestei tumori. Încurajez testarea genetică a pacienților cu GIST, pentru a alege tratamentul cel mai potrivit în fiecare caz,” a afirmat dr. Michael Heinrich, profesor la Facultatea de Medicină din cadrul Universității Oregon, Portland, și realizator al studiului care a condus la aprobarea FDA.
Rezultatele studiului
Aprobarea FDA este urmarea rezultatelor pozitive ale studiului de fază I NAVIGATOR, care a fost prezentat în cadrul Congresului Societății Americane de Oncologie ASCO 2019.
Sursa foto Blueprint Medicines
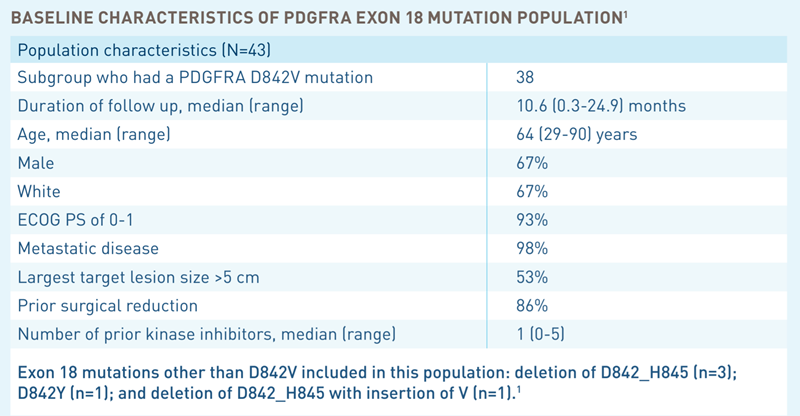
Studiul a inclus 237 de pacienți cu tumori stromale gastrointestinale, nerezecabile, care au avansat sub tratamentul cu minimum 2 inhibitori de tirozin kinază (printre care unul a fost imatinib). Dintre aceștia, 43 prezentau mutații la nivelul exonului 18, în cadrul genei PDGFRA, iar dintre aceștia din urmă, 38 prezentau cea mai frecventă mutație, D842V. Obiectivele studiului au fost de a evalua două potențiale populații responsive la avapritinib: pacienții rezistenți la multiple linii terapeutice anterioare (111 dintre pacienți au primit avapritinib în cadrul celei de-a patra linii de tratament) și pacienții cu mutații PDGFRA ex 18 (43 de pacienți). Rezultatele au fost pozitive în cadrul celui de-al doilea subgrup:
- Rata de răspuns a fost de 86% printre pacienții cu mutația PDGFRA ex 18;
- Dintre aceștia, 3 au prezentat răspuns complet și 34 răspuns parțial.
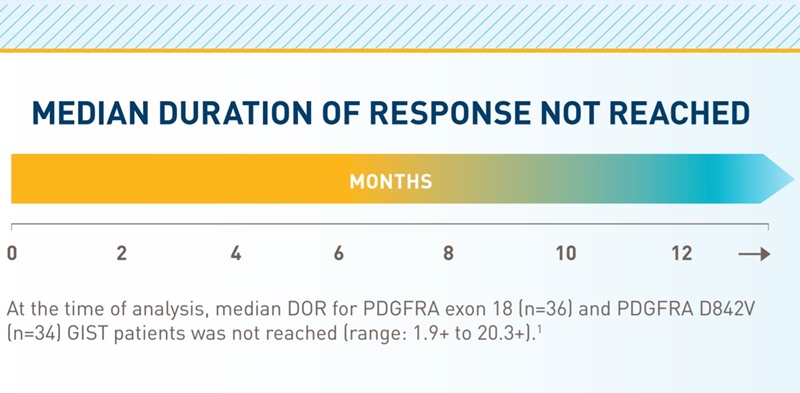
- Durata mediană de răspuns nu a putut fi calculată, deoarece pacienții au continuat să prezinte răspuns și după încheierea perioadei de urmărire.
Sursa foto Blueprint Medicines
Rezultatele în cazul pacienților care primesc avapritinib în cadrul liniei IV de tratament au fost mai modeste, însă pozitive, față de rezultatele altor terapii similare, aprobate în cadrul liniilor II și III de tratament:
- Rata de răspuns a fost de 22%;
- Durata mediană de răspuns a fost de 10.2 luni.
Despre tumorile stromale gastrointestinale
GIST reprezintă o formă rară tumorală, care provine din țesutul conjunctiv prezent la nivel intestinal, cel mai frecvent în peretele stomacului sau a intestinului subțire. În Statele Unite, sunt anual diagnosticate aprox. 5.000 de noi cazuri.
GIST este frecvent cauzat de o singură mutație: 80% dintre cazuri mutația c-KIT, iar o proporție mai mică de cazuri prezintă mutații în cadrul genei care codifică receptorul A pentru factorul de creștere derivat din plachete sangvine (PDGFRA). Deoarece aceste gene produc proteine din clasa tirozin kinazelor, tratamentul GIST include frecvent inhibitori de tirozin kinază (TKI), dintre care cel mai recent aprobat este avapritinib.
Această aprobare FDA este importantă pentru pacienții cu GIST deoarece mutația D842V, prezentă la pacienții cu rezultate pozitive din studiu, reprezintă un subtip de mutație PDGFRA care imprimă tumorii rezistență la TKI aprobați în această boală, iar avapritinib poate reprezenta singura opțiune terapeutică în acest caz.

Sursa foto Blueprint Medicines
În urma acestei aprobări ne putem aștepta și la o decizie FDA în cazul pacienților multiplu tratați în antecedente (un alt subgrup de pacienți cu rezultate pozitive în studiul NAVIGATOR), și de asemenea, la o decizie din partea EMA pentru pacienții cu GIST din UE.
Citește și:
- #ESMO19. Osimertinib crește supravieţuirea globală ca tratament de linia I pentru cancerul pulmonar non-microcelular EGFR pozitiv
- #ESMO19. Unul din doi pacienţi cu melanom metastatic supraviețuiește la 5 ani cu imunoterapia combinată nivolumab + ipilimumab
- Ogivri, trastuzumab biosimilar, eficient și sigur pentru tratamentul cancerului mamar și cancerului gastric HER2-pozitive
Sursa foto: Blueprint Medicines

