CRISPR/Cas9: promisiunile și provocările editării genice în medicină. Care sunt aplicațiile practice?
După doar 8 ani de la descoperirea sistemului de editare genomică CRISPR-Cas9, Emmanuelle Charpentier și Jennifer A. Doudna au primit premiul Nobel pentru Chimie. Cele două cercetătoare au transformat un mecanism imun bacterian, obscur, într-un instrument care poate edita într-o manieră simplă și ieftină genomul tuturor organismelor, de la plante, la animale și oameni.
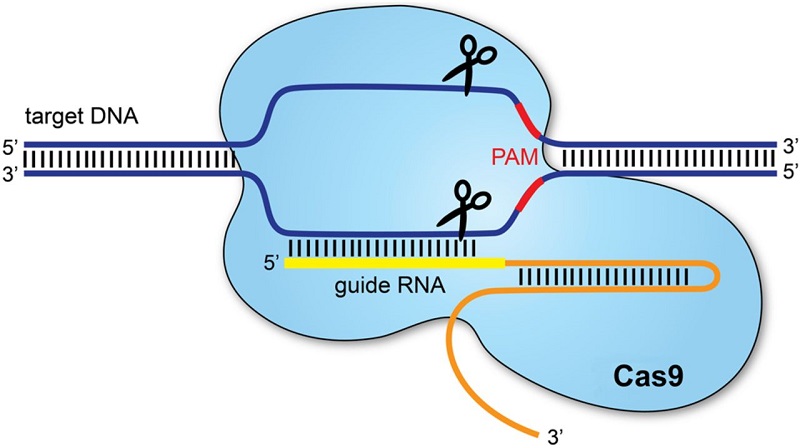
Genomul este setul complet de „instrucțiuni” genetice care determină modul în care se dezvoltă un organism. CRISPR permite „tăierea” extrem de precisă a unor porțiuni de ADN din genomul unui organism și modificarea secvenței acestuia, motiv pentru care este considerat o „foarfecă genetică”. După cum explică Dr. Jennifer Doudna, co-dezvoltator al tehnologiei de editare genomică, oamenii de știință pot edita acum genomul organismelor vii „așa cum ați putea edita un document Word”.
Din 2013, atunci când CRISPR/Cas9 a fost aplicată pentru prima dată în celulele unui mamifer ca instrument de editare a genomului, această versatilă tehnologie și-a extins rapid utilizarea de modulare a expresiei genelor, variind de la corectarea sau modificarea secvenței genomice, până la modificări epigenetice și transcripționale. Tehnologia CRISPR este un motor pentru cercetarea de bază, care însă schimbă și lumea în care trăim.
„Capacitatea de a tăia ADN-ul acolo unde vrem a revoluționat științele vieții. Foarfecele genetice au fost descoperite în urmă cu 8 ani, dar au adus deja foarte multe beneficii omenirii”, a declarat Dr. Pernilla Wittung Stafshede, biolog chimist la Universitatea de Tehnologie Chalmers, în cadrul decernării premiului Nobel.

Metoda preferată de editare genomică în prezent
Ingineria genetică – manipularea directă a ADN-ului de către oameni – a început să existe abia din anii 1970, însă sistemele bazate pe tehnologia CRISPR au schimbat fundamental acest domeniu. În trecut, au existat mai multe metode de editare a genomului dar utilizarea lor era consumatoare de timp, greoaie și costisitoare. CRISPR nu numai că funcționează cu ușurință și viteză remarcabilă, ci este și prima tehnică care permite cercetătorilor să modifice mai multe gene într-un singur experiment.
CRISPR/Cas9 este ușor de utilizat, mai ales în comparație cu instrumentele mai vechi de editare genomică. „Înainte, doar un număr restrâns de laboratoare din lume putea produce instrumentele adecvate pentru editarea genelor. Acum, chiar și un elev de liceu poate face o schimbare într-un genom complex folosind CRISPR”, a spus Prof. Dr. Alejandro Chavez, de la Universitatea Columbia, care a dezvoltat mai multe instrumente noi bazate pe tehnologia CRISPR.
CRISPR este, de asemenea, ușor de adaptat și personalizat în funcție de obiectiv. Poate edita practic orice segment de ADN din cele 3 miliarde de litere ale genomului uman și este mai precis decât alte instrumente de editare a ADN-ului.
Editarea genomică cu ajutorul CRISPR/Cas9 este mult mai rapidă. În cazul metodelor mai vechi, dura de obicei cel puțin un an-doi pentru a genera un model de șoarece modificat genetic. Dar acum, cu ajutorul tehnologiei CRISPR, un om de știință poate crea un model complex de șoarece, în câteva luni. Și în plus, este cu siguranță mai ieftin decât metodele anterioare.
Mai mult decât atât, CRISPR poate fi ușor augmentat. Cercetătorii pot folosi sute de ARN-uri ghid pentru a manipula și evalua sute sau mii de gene la un moment dat. În domeniul cancerului, se folosește adesea acest tip de experiment pentru a alege gene care ar putea reprezenta ținte bune terapeutice.
O revoluție tehnologică cu posibilități nesfârșite de utilizare
Tehnologia CRISPR/Cas9 are în prezent un impact uriaș asupra domeniului medical. Există mii de lucrări de cercetare publicate în fiecare an cu privire la diferitele sale aplicații. Până în prezent, sistemele CRISPR/Cas au fost utilizate pentru a investiga genele țintă în modificarea genomului, matisarea, transcrierea și reglarea epigenetică, și pentru investigarea și tratarea bolilor genetice, bolilor infecțioase, cancerului și bolilor imunologice. Printre progresele interesante, utilizarea translațională a CRISPR/Cas în bolile genetice monogenice are potențialul de a oferi un răspuns terapeutic pe termen lung după un tratament unic.
Pe lângă domeniul medical, CRISPR are un mare potențial și în producția de alimente, pentru a îmbunătăți calitatea culturilor, pentru a obține rezistență la boli și rezistență la erbicide. Spre deosebire de metodele GMO (organisme modificate genetic), CRISPR-Cas9 nu implică introducerea ADN-ului de la plante compatibile, cu reproducere asexuată. Această diferență cheie ar putea permite metodelor de editare genomică, precum CRISPR-Cas9, să obțină o acceptare pe scară mai largă din partea consumatorilor, precum și un proces ceva mai simplu de reglementare. CRISPR oferă, de asemenea, posibilitatea de a aborda problema alergiilor alimentare prin rescrierea acelor regiuni ale genei care sunt recunoscute de sistemul imunitar și care provoacă o reacție alergică. CRISPR-Cas9 este studiată și în vederea modificării ADN-ului grâului pentru a elimina glutenul, făcându-l potrivit pentru pacienții cu boală celiacă. Cu toate acestea, reglementarea strictă a U.E. privind utilizarea editării genomice la plante ar putea face dificilă vizibilitatea acestor proiecte, cel puțin în Europa.
Utilizat la animale, CRISPR poate duce la o mai bună rezistență la boli și la caracteristici productive îmbunătățite – adică animale care produc mai multă carne, lapte sau lână de înaltă calitate.
Editarea genomică poate fi de asemenea una dintre soluțiile pentru a aborda schimbările climatice. Un raport din septembrie 2020 al Fundației pentru Tehnologia Informației și Inovării (ITIF), Editare genică pentru climă: soluții biologice pentru reducerea emisiilor cu efect de seră, subliniază faptul că tehnologia de editare genetică ar putea fi utilizată pentru a dezvolta soluții climatice și de energie curată pe care decidenții politici le-au trecut cu vederea până în prezent.
CRISPR, introdus direct în organismul uman pentru prima dată
La începutul acestui an, un pacient cu o afecțiune genetică care provoacă orbire a devenit prima persoană care a primit o terapie genică administrată direct în organismul său. Tratamentul face parte dintr-un studiu clinic de referință pentru a testa capacitatea tehnicilor CRISPR-Cas9 de a elimina mutația CEP290 care provoacă o afecțiune rară numită amauroza congenitală Leber 10.
Această afecțiune genetică este o țintă deosebit de atractivă pentru o abordare de editare genomică. Terapiile genice convenționale folosesc un virus pentru a insera o copie sănătoasă a genei mutante în celulele afectate. Dar gena CEP290 este prea mare pentru a insera întreaga genă într-un genom viral. Și, deși mutațiile CEP290 dezactivează fotoreceptorii din retină (celulele care detectează lumina), aceștia sunt încă prezenți și vii la persoanele cu amauroză congenitală Leber. Speranța este că editarea genomică poate reactiva aceste celule, fiind una dintre puținele boli în care oamenii de știință cred că ar putea duce de fapt la o îmbunătățire a vederii.
„Acest studiu marchează o nouă eră în medicină, folosind o tehnologie care permite editarea ADN-ului mult mai ușor și eficient”, a declarat Dr. Jason Comander, medic chirurg oftalmolog la Massachusetts Eye and Ear din Boston, un alt spital care plănuiește să înroleze pacienți în studiu.
CREDIT: Oregon Health & Science University
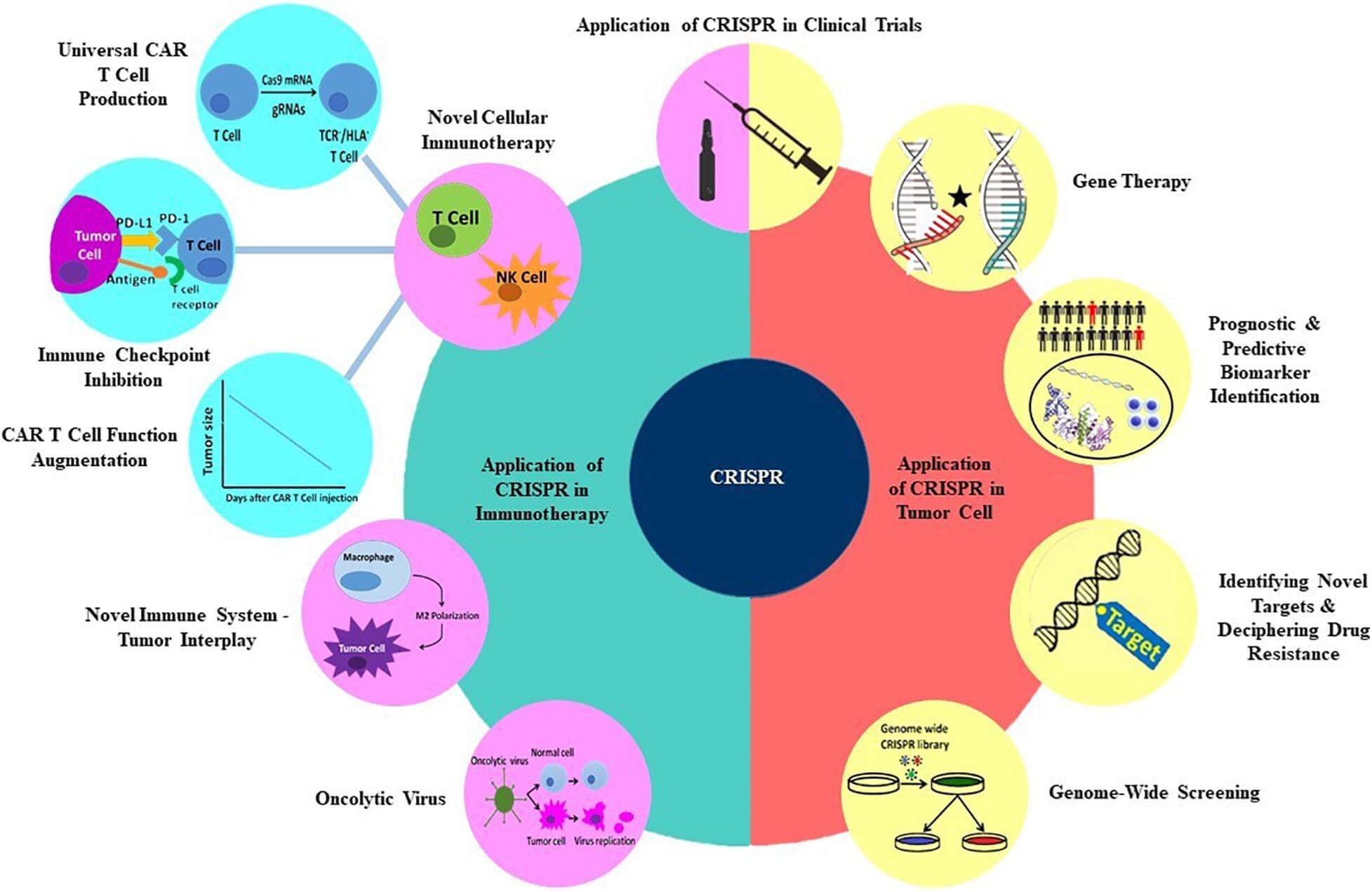
CRISPR/Cas9: De la editarea genelor tumorale, la imunoterapia prin celule T
Oamenii de știință au căutat o modalitate ușoară de a manipula ADN-ul încă de când au realizat că modificările ADN cauzează cancer printr-o acumulare excesivă de mutații care duc la activarea oncogenelor și la inactivarea genelor supresoare tumorale. Deși au fost dezvoltate mai multe metode de editare genică de-a lungul anilor, niciuna nu a îndeplinit criteriile de tehnologie rapidă, ușoară și ieftină.
CRISPR/Cas9 a condus la o schimbare de paradigmă în abordarea tratamentului cancerului încă din ziua în care a fost prezentată comunității științifice. De îndată ce CRISPR și-a făcut loc în laboratoarele din întreaga lume, cercetătorii în domeniul oncologiei au profit de șansa de a o folosi, devenind o tehnologie utilizată în mod obișnuit în multe studii de biologie a cancerului datorită comodității tehnicii.
Modificări în reglarea genelor responsabile de tumorigeneză, numite oncogene și gene supresoare tumorale, mediază rezistența la terapie și progresia cancerului. Tehnologia CRISPR permite inactivarea oncogenelor sau restaurarea genelor supresoare tumorale, precum și a funcțiilor apoptotice și imunostimulatoare. CRISPR/Cas a fost utilizată pentru descoperirea și introducerea unor gene supresoare tumorale și a căilor înrudite ca ținte terapeutice noi. În plus, permite identificarea mecanismelor responsabile de inducerea rezistenței la medicamente și a genelor care stau la baza acestor fenomene.
CRISPR/Cas poate servi, de asemenea, ca instrument valoros pentru identificarea biomarkerilor prin evaluarea modificărilor genetice sau epigenetice din țesutul tumoral.
Manipularea genică mediată de CRISPR/Cas s-a străduit să abordeze unele dintre provocările referitoare la funcționarea defectuoasă a sistemului imunitar din diferite perspective: identificarea unei noi interacțiuni a sistemului imunitar-tumoră, o nouă imunoterapie celulară, producție universală de celule CAR T, creșterea funcționalității celulelor CAR T, inhibarea punctelor de control imun.
Acum, CRISPR se mută din laboratoarele științifice și se îndreaptă spre studiile clinice la pacienții cu cancer.
- Primul studiu clinic care a utilizat tehnologia CRISPR în cancer
În 2019, într-un prim studiu clinic restrâns din SUA, cercetătorii au testat un tratament oncologic care implică celule T imune editate cu ajutorul tehnologiei CRISPR pentru a vâna și a ataca mai bine cancerul. Terapia presupune efectuarea a patru modificări genetice la nivelul celulelor T (numite celule T NYCE), care au fost apoi crescute în număr mare și perfuzate pacienților.
Constatările inițiale sugerează că tratamentul este sigur – nu au existat dovezi ale unei reacții imune față de celulele editate prin CRISPR. Cu toate acestea, tratamentul a avut un efect mic asupra cancerului – tumorile a doi pacienți (mielom multiplu și sarcom) au încetat să crească pentru o perioadă, dar au reluat creșterea ulterior, iar tratamentul nu a funcționat deloc pentru al treilea pacient.
Deși studiul arată că terapia celulară editată CRISPR este posibilă, efectele pe termen lung trebuie monitorizate. Celulele T NYCE sunt „sigure atâta timp cât îi urmărim pe participanții la studiu. Planul nostru este să îi monitorizăm în continuare, ani de zile, dacă nu chiar decenii”, au spus cercetătorii.
-
Mai multe studii despre tratamente oncologice pe baza CRISPR în viitor
În timp ce studiul celulelor T NYCE a marcat primul studiu al unui tratament pentru cancer bazat pe CRISPR, este probabil ca în viitorul apropiat să apară mai multe. Alte studii clinice ale tratamentelor oncologice produse prin CRISPR sunt deja în desfășurare. Câteva studii testează terapiile cu celule CAR-T concepute pe baza CRISPR, un alt tip de imunoterapie. De exemplu, o companie testează astfel de celule CAR-T la pacienții cu neoplasme hematologice de linie B și cei cu mielom multiplu.
Există încă o mulțime de întrebări cu privire la toate modurile în care CRISPR ar putea fi utilizată pentru cercetarea și tratamentul cancerului. Dar un lucru este sigur: domeniul progresează incredibil de repede iar noile aplicații ale tehnologiei apar în mod constant.
Crearea modelelor de boli folosind CRISPR/Cas
Generarea de modele de boală este necesară pentru înțelegerea mecanismelor bolii și dezvoltarea de noi strategii terapeutice. Tehnologia CRISPR/Cas a fost utilizată pe scară largă pentru crearea de modele celulare legate de boli, cum ar fi distrofia musculară Duchenne, keratopatia asociată cu aniridia, osteogenesis imperfecta, adrenoleucodistrofia X linkată și boala Alzheimer.
Mai mult decât atât, utilizând CRISPRCas, cercetătorii au creat o serie de modele de șoareci care reproduc unele boli: distrofia musculară Duchenne, ateroscleroza, obezitatea și diabetul, rezistență la hormonul tiroidian prin mutația THRA și boala Alzheimer. CRISPR/Cas a fost, de asemenea, utilizată pentru a genera modele de boală la animale mari.
Tehnologia CRISPR/Cas oferă un mijloc flexibil și ușor de utilizat de a dezvolta modele de boli pentru a explora cauzele genetice ale acestora și pentru a evalua strategii terapeutice.
Corectarea bolilor folosind CRISPR/Cas
Tulburările ereditare de sânge reprezintă candidați buni pentru terapiile genice deoarece pot modifica gena în cauză la nivelul celulelor stem hematopoietice autologe și pot corecta sistemul hematopoietic. Până în 2019 au fost inițiate trei studii clinice care aveau ca scop tratarea pacienților cu β-talasemie și drepanocitoză (siclemie) severe prin transfuzie de celule stem hematopoietice CD34+ editate CRIPSR/Cas9.
Distrofia musculară congenitală tip 1A, una dintre tulburările neuromusculare, este cauzată de mutația genei LAMA2, care codifică laminina-α2. CRISPR a fost utilizată pentru a regla gena LAMA1, care codifică laminina-a1, stimulând-o și compensând astfel pierderea lamininei-a2. Astfel s-a ameliorat pierderea musculară și paralizia la modelul de șoareci, oferind o nouă abordare pentru corectarea bolii.
CRISPR/Cas a fost utilizată pentru a bloca antitripsina alfa-1 mutantă, reducând astfel fenotipul hepatic patologic, și pentru a corecta o mutație punctuală la nivelul alfa-1 antitripsinei la pacienții cu deficit de alfa-1 antitripsină.
Bolile pulmonare monogenice cauzate de mutațiile genelor pentru surfactant benficiază de puține opțiuni terapeutice. Folosind un sistem CRISPR de raportare fluorescentă, cercetătorii au temporizat cu exactitate livrarea intra-amniotică a componentelor CRISPR/Cas9 într-un model de șoarece pentru a inactiva gena SFTPCI73T mutantă. Editarea prenatală a genelor a ameliorat fiziopatologia pulmonară, a îmbunătățit dezvoltarea pulmonară și a crescut rata de supraviețuire.
Fibroza chistică este o altă boală pulmonară monogenică, cauzată de mutații ale genei CFTR. Cu ajutorul editării genice prin CRISPR, a fost posibilă recuperarea funcției CFTR în celulele epiteliale respiratorii.
Cel puțin jumătate din toate cazurile de surditate congenitală sunt cauzate de mutații genetice, însă există puține tratamente pentru a încetini sau a inversa evoluția. Recent, oamenii de știință au livrat „in vivo” complexe de ARN-ghid Cas9 pentru a perturba alela dominantă asociată cu surditatea la un model de șoarece, ceea ce a ameliorat pierderea auzului.
Provocări și controverse
„Odată cu o putere mare, vine și o mare responsabilitate”. Tehnologia CRISPR/Cas nu este perfectă, iar dezavantajele sale au făcut ca mulți oameni de știință să fie prudenți în privința utilizării sale la oameni. Unele dintre întrebările ridicate de această tehnologie sunt: „Ce înseamnă această tehnologie pentru modul în care trăim și murim?” și „Doar pentru că putem edita viața, ar trebui să o facem?”. Este nevoie de o discuție amplă privind reglementarea unei astfel de tehnologii, mai ales având în vedere aplicațiile și potențialul său vast.
O serie de provocări ale tehnologiei rămân – unele sunt tehnice, cum ar fi riscul modificărilor nedorite care se întâmplă atunci când Cas9 „taie” în locații neintenționate din genom. Aceste modificări neintenționate ar putea fi dăunătoare și ar putea chiar transforma celulele sănătoase în unele canceroase. Dar prin modificarea structurilor Cas și a ARN-ului de ghidare, oamenii de știință au îmbunătățit capacitatea CRISPR de a acționa doar la nivelul țintei dorite.
Un alt potențial obstacol este introducerea componentelor CRISPR în interiorul celulelor umane. Cel mai comun mod de a face acest lucru este prin utilizarea unui virus. În loc să transmită gene cauzatoare de boli, virusul este modificat pentru a transporta gene pentru ARN-ul ghid și Cas. Introducerea sistemelor CRISPR în celulele cultivate în laborator este un aspect, dar a le introduce în celule din organismul unei persoane este o provocare. Unele virusuri utilizate în acest scop pot infecta mai multe tipuri de celule dincolo de celulele țintă. Cercetătorii explorează diferite modalități de a regla fin administrarea CRISPR către organe sau celule specifice din corpul uman – virusuri care infectează un singur organ sau structuri minuscule (nanocapsule) concepute pentru a furniza componente CRISPR către celule specifice.
Deoarece tehnologia CRISPR abia începe să fie testată la subiecți umani, există și îngrijorări cu privire la modul în care organismul, în special sistemul imunitar, va reacționa la virusurile transportatoare sau la componentele CRISPR în sine. Există întrebări legate de posibilitatea ca sistemul imunitar să atace Cas și să distrugă celulele editate de CRISPR. Abordările mai noi ale CRISPR se bazează pe virusuri care par a fi mai sigure decât cele utilizate pentru terapiile genice mai vechi.
O altă preocupare majoră este că editarea celulelor din interiorul corpului ar putea conduce în mod accidental la modificări la nivelul spermatozoizilor sau ale ovulelor, care pot fi transmise mai departe generațiilor viitoare. În aproape toate studiile umane în desfășurare care implică CRISPR, celulele pacienților sunt îndepărtate și editate în afara organismului. Această abordare „ex vivo” este considerată mai sigură deoarece este mai controlată comparativ cu editarea celulelor din interiorul corpului. Cu toate acestea, în cazul editării genice din amauroza congenitală Leber prin intermediul sistemului CRISPR, tehnice a fost utilizată direct în ochii persoanelor cu această boală genetică.
Alte probleme sunt de natură etică. CRISPR a fost folosită într-unul dintre cele mai controversate experimente din ultimii ani. Un biofizician chinez a încercat fără succes să folosească tehnologia pentru a modifica embrionii umani și a conferi rezistență la HIV. Acesta a fost blamat pe scară largă și în cele din urmă condamnat la închisoare în China, o țară care a devenit lider în domeniul de cercetare al editării genomice.
Oamenii de știință încă îmbunătățesc metodele de aplicare a sistemelor de editare genică – CRISPR/Cas – și încearcă să se ocupe de aspectele etice, morale. Este o arie de cercetare și dezvoltare intensă și, sperăm că tehnologia CRISPR va avea aplicații și mai largi în viitorul apropiat.

