FDA a aprobat a treia terapie de tip „tumor-agnostic”, entrectinib, cu indicații în cancerele care exprimă fuziuni NTRK și în cancerul pulmonar ROS1+
Entrectinib (Rozlytrek) a fost aprobat de Food and Drug Administration (FDA) printr-o procedură accelerată, pentru tumorile solide care prezintă fuziuni NTRK, la pacienții adulți și pediatrici. De asemenea, medicamentul a primit aprobare și pentru tratamentul cancerului pulmonar non-microcelular ROS1 pozitiv, la adulți. Acest moment marchează a treia aprobare a unui tratament pentru cancer în funcție de prezența biomarkerilor moleculari și nu în funcție de localizarea tumorii.
În 2017, FDA aproba pembrolizumab pentru tumorile care prezintă instabilitate microsatelitară (MSI-H) iar în 2018, larotrectinib pentru tumorile care exprimă fuziuni NRTK. Recent, larotrectinib a primit recomandarea de aprobare din partea Agenției Europene a Medicamentului.
Entrectinib este primul tratament aprobat de FDA care țintește ambele tipuri de anomalii genetice – NTRK și ROS1. Acesta demonstrează răspunsuri favorabile și în cazurile cu metastaze cerebrale, spre deosebire de larotrectinib, rezultat foarte important mai ales în cazul NSCLC.
Entrectinib a primit Statut Prioritar (Priority Review) și desemnarea de Terapie Inovatoare (Breakthrough Therapy) și Medicament Orfan (Orphan Drug).
De asemenea, aprobarea deschide o nouă etapă în dezvoltarea de medicamente inovatoare și vine în contextul unor schimbări recente în ghidurile FDA. Anul trecut, agenția a emis un document care grupează o serie de recomandări pentru producătorii de medicamente legate de dezvoltarea terapiilor țintite și criteriile de împărțire a pacienților în studii clinice, mai ales pentru cazurile cu frecvență scăzută a anomaliilor moleculare.
Comisarul FDA, Ned Sharpless a declarat:
„Ne aflăm într-o era a inovației tratamentului cancerului pe măsură ce vedem aceste progrese în dezvoltarea terapiilor tumor-agnostic, acestea având potențialul de a transforma terapia oncologică. Observăm, de asemenea, modul în care biomarkerii continuă să aibă un rol esențial în dezvoltarea de noi medicamente și schimbarea practicii clinice conform standardelor medicinei de precizie”
Entrectinib – aprobat pentru pacienții cu tumori solide local avansate sau metastatice care exprimă fuziunea NTRK, la care boala a progresat sub tratamente anterioare sau ca primă linie, dacă nu există alte opțiuni.
Această aprobare s-a bazat datele din 4 studii, care au inclus pacienți din 15 țări.
Studiile realizate în populația adultă
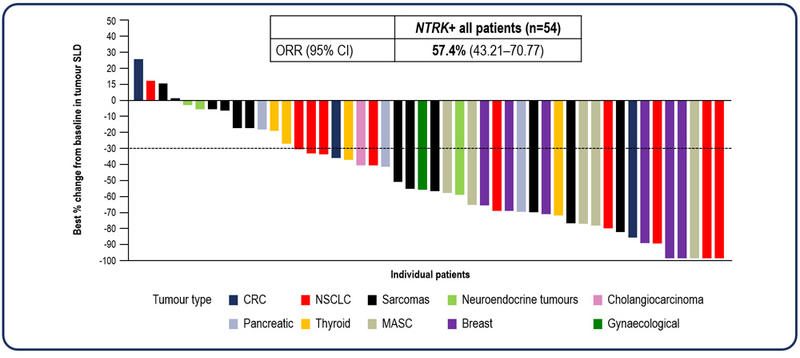
Entrectinib a determinat reducerea dimensiunilor tumorale, conform datelor unei analize a 3 studii care au inclus în total 54 de adulți care prezentau cancere la care se identificau anomalii genetice specifice ale genei NTRK.
Studiile au înrolat pacienți cu 10 tipuri de tumori, reprezentând peste 19 tipuri histopatologice. Acestea au inclus cazuri de cancer de sân, colangiocarcinom, cancer colorectal, cancere ginecologice, tumori neuroendocrine, carcinom pulmonar non-microcelular, cancer de glande salivare, cancer pancreatic, sarcom și cancer tiroidian. Mulți pacienți prezentau și metastaze la nivelul sistemului nervos central. Vârsta medie a fost de 57,5 ani, iar femeile au reprezentat 60% din populația inclusă. Peste 40% dintre pacienți au primit cel puțin 2 linii de tratament în antecedente, iar 37% erau cazuri netratate anterior.
- Studiul de fază II, STARTRK-2 este un trial multicentric în care au fost înrolați pacienți cu tumori solide care prezentau mutații la nivelul genelor NTRK1/2/3, ROS1 și ALK;
- STARTRK-1 este un studiu de fază I multicentric desfășurat în SUA și Coreea de Sud care a stabilit schema recomandată de dozare a medicamentului;
- ALKA-372-001 este un alt studiu, desfășurat în Italia care a evaluat schemele optime de dozare ale medicamentului. În cadrul studiului au participat pacienți cu tumori solide avansate care prezentau fuziuni la nivelul TRKA/B/C, ROS1 sau ALK.
Analiza studiilor a arătat următoarele rezultate:
- La 57,4% dintre pacienți s-a observat o reducere semnificativă a dimensiunilor tumorale iar la 7,4% tumorile au dispărut complet;
- În cazul celor 31 de pacienți la care tumorile s-au micșorat, 61% au înregistrat un răspuns care s-a menținut cel puțin 9 luni
- Rata generală de răspuns (ORR) în cazurile cu diseminări cerebrale a fost de 54,5%, iar mai mult de 25% dintre aceștia au obținut un răspuns complet.
Eficacitatea medicamentului în populația pediatrică
Aprobarea entrectinib s-a bazat și pe datele din studiul de fază I/II STARTRK-NG care a înrolat pacienți cu vârsta cuprinsă între 4,9 luni și 20 de ani, cu tumori rare de sistem nervos central (SNC), neuroblastom sau alte tumori solide. Majoritatea pacienților cu tumori de SNC suferiseră anterior o intervenție chirurgicală pentru îndepărtarea tumorii și radioterapie. Conform datelor prezentate anul acesta la ASCO, toți pacienții incluși în studiu au răspuns la tratament.
„FDA încurajează includerea adolescenților în studii clinice. În mod obișnuit, dezvoltarea clinică a unui medicament pentru populația pediatrică, nu ar începe până când acesta nu este deja aprobat pentru o indicație la adulți. Indicația medicamentului pentru adolescenți s-a bazat pe date de siguranță și eficacitate demonstrate în cazul a 30 de pacienți pediatrici” – Dr. Richard Pazdur, Directorul Centrul de Excelență în Oncologie, FDA
Aprobarea pentru cancerul pulmonar non-microcelular metastatic, ROS-1 pozitiv
ROS1 este o tirozin kinază cu rol important în controlul proliferării celulare. Fuziunile la nivelul genei ROS1 apar în 1-2% din cazurile de NSCLC, mai ales la pacienții tineri, nefumători.
Analiza care a dus la aprobarea entrectinib a evaluat și 51 de pacienți adulți cu neoplasm pulmonar ROS-1 pozitiv incluși în studii.
- Rata de răspuns generală a fost de 78%, iar 5,9% dintre pacienți au înregistrat răspunsuri complete;
- Dintre cei 40 de pacienți care au răspuns la tratament, pentru 55% eficacitatea s-a menținut pentru cel puțin 12 luni;
- Entrectinib a redus tumorile intracranine la peste 50% dintre pacienții cu metastaze SNC.
O diferență importantă față de larotrectinib este activitatea asupra sistemului nervos central. Entrectinib determină răspunsuri și în cazul diseminărilor cerebrale. O treime dintre pacienții cu NSCLC prezintă metastaze cerebrale la momentul diagnosticului, iar două treimi dezvoltă astfel de metastaze în timpul tratamentului.
Pașii următori
Testarea biomarkerilor ROS1 și NTRK va fi esențială pentru identificarea pacienților cu tumori solide care pot beneficia de tratamentul cu entrectinib. Urmează a fi depusă o cerere către FDA pentru aprobarea testului de tip companion diagnostic Foundation One CDx pentru entrectinib.
Citește și
- STUDIU: Larotrectinib, eficient în 17 tipuri de cancer în care este evidențiată fuziunea TRK. Se deschide era medicamentelor “tumor-agnostic” în terapia cancerului
- #ASCO19. Terapia țintită cu entrectinib determină răspuns la copiii cu tumori solide care prezintă fuziuni genetice specifice
- #ESMO18. Terapia personalizată cu entrectinib eficientă în 10 tipuri diferite de tumori solide NTRK-pozitive

