#ASCO19. Terapia țintită cu entrectinib determină răspuns la copiii cu tumori solide care prezintă fuziuni genetice specifice
Tratamentul țintit cu entrectinib a determinat răspuns favorabil la copiii diagnosticați cu tumori rare de sistem nervos central, neuroblastom sau alte tumori solide, care prezentau fuziuni la nivelul NTRK 1/2/3, ROS1, genelor ALK sau mutație ALK. Rezultatele sunt preliminare, fiind obținute în cadrul unui studiu clinic de fază I/IB, și au fost prezentate la congresul anual al Societății Americane de Oncologie Clinică (ASCO), desfășurat în perioada 31 mai – 4 iunie 2019 în Chicago.
„În populația pediatrică s-au desfășurat mult mai puține studii asupra terapiilor oncologice țintite decât la adulți. Deși aceste rezultate necesită cercetări ulterioare, ne arată posibilitatea primului tratament oncologic eficient la copii, bazat pe genetica tumorilor, nu pe localizare sau tipul histologic”, a declarat președintele ASCO, Dr. Monica Bertagnolli, FACS, FASCO.
Studiul clinic STARTRK-NG a înrolat 29 de pacienți cu vârsta cuprinsă între 4.9 luni și 20 de ani (vârsta mediană fiind de 7 ani), care prezentau tumori rare de sistem nervos central (SNC), neuroblastom sau alte tumori solide. Majoritatea pacienților cu tumori de SNC suferiseră anterior o intervenție chirurgicală pentru îndepărtarea tumorii, urmată de radioterapie.
Faza I a studiului a urmărit evaluarea dozajului optim. Studiul a fost extins (faza IB) pentru a se concentra asupra pacienților cu tumori care prezentau alterări genetice. Din cei 29 de pacienți, 12 prezentau aceste modificări:
- fuziune la nivelul NTRK 1/2/3 (neurotrophic tropomyosin receptor kinase), ROS1 (ROS proto-oncogene 1, receptor tyrosine kinase), genelor ALK (anaplastic lymphoma kinase) – 11 pacienți;
- mutație ALK (1 pacient).
În total, 12 pacienți au înregistrat răspuns obiectiv la tratamentul cu entrectinib, după o durată medie de 281 de zile de tratament cu doze de cel puțin 400 mg/m². Răspunsul la entrectinib s-a obținut numai la pacienții care prezentau alterări genice țintite de tratament iar durata medie necesară pentru răspuns a fost de 57 de zile.
Răspunsul complet a fost definit ca dispariția oricărei urme de boală și ameliorare/stabilitate neurologică. Răspunsul a fost considerat parțial în cazul reducerii cu cel puțin 30% a tumorilor solide, respectiv cel puțin 50% a tumorilor de SNC, însoțită de stabilitate neurologică. Absența modificărilor în progresia sau regresia bolii a fost considerată boală staționară. Boala a fost declarată progresivă în cazul creșterii cu cel puțin 20% a tumorilor solide și cu peste 25% a tumorilor de SNC, sau declinul statusului neurologic.
„Rezultatele ne arată că pacienții pediatrici cu forme de cancer amenințătoare de viață pot beneficia enorm, chiar și după ce alte terapii convenționale nu au funcționat. Răspunsurile înregistrate au fost rapide și durabile și ne sugerează că această terapie oferă o promisiune uriașă pentru acei copii cu tumori prezentând fuziuni specifice ale genelor”, a afirmat autorul studiului, Dr. Giles W. Robinson, medic pediatru neuro-oncolog la St. Jude Children’s Research Hospital, S.U.A.
Mutațiile genetice prezentate de pacienții care au răspuns la tratamentul cu entrectinib au fost următoarele, în funcție de tipul de cancer:
- 5 pacienți cu tumori de SNC evaluați – Toți au prezentat răspuns obiectiv: 1 pacient a răspuns complet (fuziune a genelor ETV6-NTRK3) iar 4 pacienți au răspuns parțial (3 cu fuziuni genice confirmate la nivelul TPR-NTRK1, EEF1G-ROS1, EML1-NTRK2 și 1 cu fuziune genică neconfirmată la nivelul GOPC-ROS1). În cadrul studiului mai este un pacient cu tumoră de SNC (fuziune KANK1-NTRK2) care urmează a fi evaluat;
- 6 pacienți cu tumori solide extracraniene (tumori inflamatorii miofibroblastice, fibrosarcom infantil, melanom) – Un pacient a răspuns complet (fuziune DCTN1-ALK) iar 5 pacienți au răspuns parțial (fuziuni genice TFG1-ROS1, EML4-NTRK3, KIF5B-ALK, ETV6-NTRK3);
- 1 pacient cu neuroblastom a înregistrat răspuns complet (mutație ALK F1174L).
Entrectinib a fost bine tolerat de către pacienți și, conform Dr. Robinson, nu pare să existe un interval de timp după care medicamentul încetează să mai funcționeze sau toxicitatea devine prea mare, limitând utilizarea.
Doză zilnică recomandată de entrectinib a fost de 550 mg/m². Reacțiile adverse înregistrate au constat în: oboseală, disgeuzie (scăderea simțului gustativ), creștere ponderală, creșterea nivelului creatininei (marker al funcției renale). S-a înregistrat un episod de edem pulmonar în cazul utilizării unei doze mai ridicate.
Studiul clinic este în desfășurare. În curând va începe recrutarea pacienților pentru faza a II-a, pentru a stabili eficacitatea medicamentului, precum și eventualele efecte adverse pe termen lung și durata răspunsului în timpul și după tratament.
Despre terapia țintită cu entrectinib
Entrectinib este un medicament sistemic cu administrare orală, care penetrează la nivelul sistemului nervos central. Este un inhibitor selectiv al tirozin-kinazei active a SNC și blochează activitatea proteinelor în legătură cu mutații ale NTRK 1/2/3, ROS1 și a genelor ALK. Fuziunea acestor gene conduce la proliferarea celulelor tumorale iar prin blocarea lor este promovată moartea celulelor canceroase. Entrectinib se distinge de celelalte medicamente din clasa sa prin spectrul larg de activitate: țintește mutații multiple.
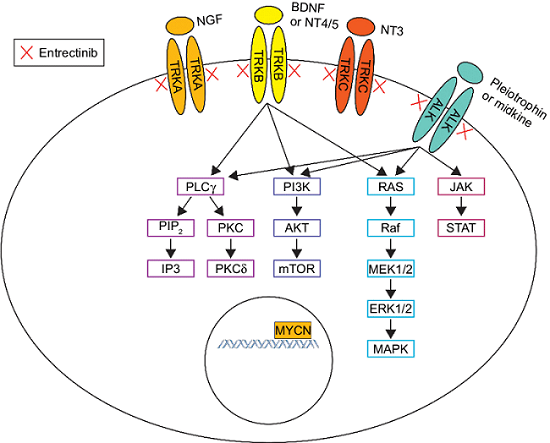
Entrectinib a fost aprobat de către FDA (Food and Drug Administration) ca “Breakthrough Therapy Designation” și de către EMA (Agenția Europeană a Medicamentului) ca “Priority Medicine” pentru tratamentul tumorilor solide pozitive pentru fuziunea NTRK, local avansate sau metastazate, la pacienții adulți și pediatrici. Aceste denumiri sunt rezervate medicamentelor care demonstrează îmbunătățiri substanțiale față de terapiile existente sau în cazul în care există nevoi medicale nesatisfăcute.
Citește și:
- #ESMO18. Terapia personalizată cu entrectinib eficientă în 10 tipuri diferite de tumori solide NTRK-pozitive
-
#ASCO19. O dietă echilibrată reduce mortalitatea prin cancer de sân la femeile în post-menopauză

