Perspective în tratamentul fibrozei pulmonare idiopatice: ipoteze științifice, studii clinice în derulare și noi rezultate terapeutice
Fibroza pulmonară idiopatică este o boală fatală, de cauză necunoscută. Momentan există doar doi agenți antifibrotici aprobați și multe alte terapii experimentale. Nintedanib și pirfenidona au deschis „o nouă eră” în tratamentul FPI însă acesta a reprezentat doar primul pas. Alte molecule se află în studii preclinice și pot schimba în viitor prognosticul pacienților cu FPI.
Cu toate acestea, sondajele arată că medicii nu sunt informați cu privire la posibilele terapii pentru FPI. De asemenea, pacienții caută alternative pe cont propriu, precum terapia cu celule stem. Până la 80% dintre medicii care tratează fibroza pulmonară idiopatică consideră că întârzierea progresiei bolii este principalul obiectiv al tratamentului, iar 50% sunt preocupați de efectele secundare are tratamentelor folosite.
Mecanismele implicate în apariția FPI sunt încă incomplet înțelese și modelele experimentale care pot reproduce modificările pulmonare sunt încă limitate, deși progresele în biotehnologie par să ofere perspective bune în acest sens.
Procesul de îmbătrânire este un factor de risc important în FPI iar anomaliile caracteristice ar fi epuizarea celulelor stem, disfuncții mitocondriale, driftul epigenetic, afectarea telomerelor, etc.
S-a ajuns la concluzia că nu există un singur mecanism responsabil de leziunile pulmonare întâlnite în FPI, iar fiecare bolnav prezintă o anumită alterare la nivelul celulelor epiteliale care crește vulnerabilitatea la diferiți factori de mediu, precum fumul de țigară, refluxul acid, infecțiile virale. Acești factori determină leziuni repetate care se traduc printr-o semnalizare alterată între epiteliu și țesutul mezenchimal, rezultând un țesut cicatricial care modifică funcția pulmonară.
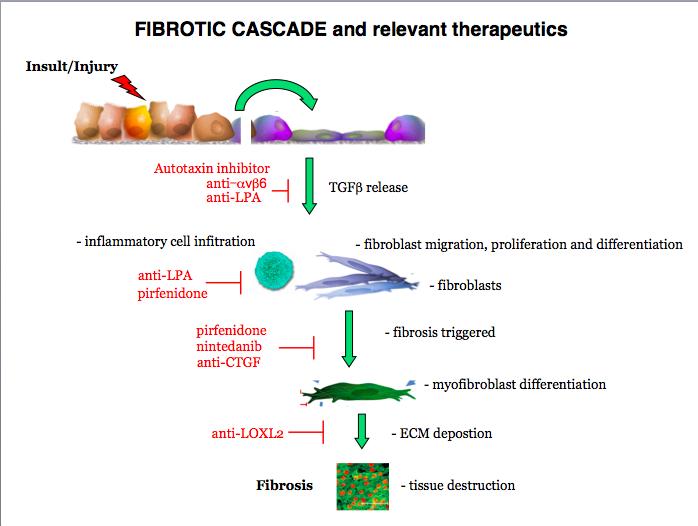
TGF-β – ținta moleculară care a deschis o „nouă era în tratamentul FPI”
Observația că în patogenia FPI există un răspuns aberant de reparare tisulară prin implicarea TGF-β (transforming growth factor beta), dar și a altori factori de creștere a determinat dezvoltarea celor două medicamente antifibrotice – nintedanib și pirfenidona. Aprobate în 2014, substanțele au reprezentat un punct culminant după decenii de cercetare. Pirfenidona, primul tratament aprobat, reduce proliferarea fibroblaștilor, inhibă producerea de colagen stimulat de TGF-beta și reduce producerea de mediatori implicați în fibrogeneză. Nintedanib este un inhibitor de multipli receptori tirozin-kinazici.
Pe lângă cele două substanțe, există și alte molecule studiate în prezent care nu doar încetinesc procesul de fibroză, ci și ar putea stopa anumite mecanisme implicate în ciclul de fibroproliferare întâlnit în FPI.
TGF-β este un factor de creștere cu efecte pleiotrope care include efectul de supresie tumorală și de reglare a proceselor de inflamație. Utilizarea acestei molecule ca țintă directă ar putea crește riscul de cancer sau de răspuns inflamator necontrolat.
CTGF este o proteină a matrixului extracelular care interacționează cu TGF-β și îi influențează efectele – poate bloca acțiunea pro-fibrotică fără să afecteze proprietățile anti-proliferative și imunosupresive.
Pamrevlumab este un anticorp monoclonal ce are ca țintă CTGF și a fost investigat în studiul de fază 2 PRAISE prezentat în cadrul ATS 2018 (American Thoracic Society). Substanța a demonstrat rezultate pozitive atât în ceea ce privește funcția pulmonară, cât și în ceea ce privește reducere fibrozei. Mai mult decât atât, pamrevlumab a determinat o îmbunătățire vizibilă la investigațiile CT.
Antagoniștii receptorilor LPA
LPA (Lysophosphatidic acid) este un fosfolipid generat ca răspuns la afectarea epitelială, ce are ca efect recrutarea fibroblaștilor la acel nivel. Antagoniștii receptorilor LPA reduc leziunea epitelială și proliferarea fibroblastică. BMS-986020 este unul dintre acești antagoniști iar un studiu de fază II a indicat că determină o scădere semnificativă a declinului funcției pulmonare. Cu toate acestea, profilul de siguranță al antagoniștilor LPA este încă un subiect de cercetare, având în vedere efectele secundare hepatobiliare.
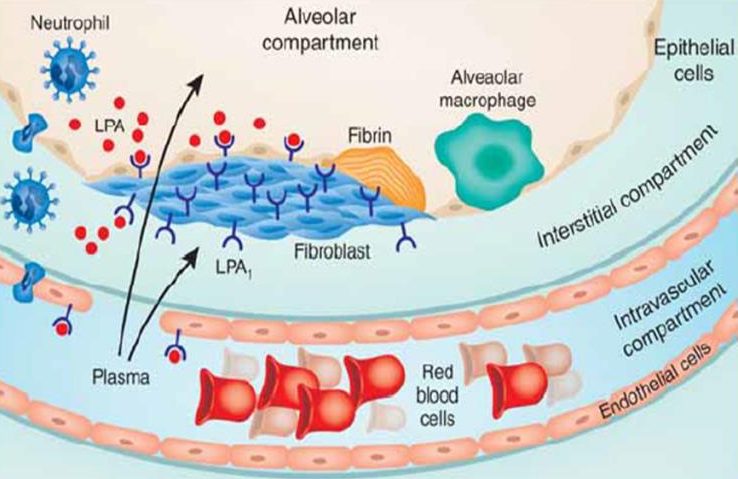
BG00011 – Blocarea activării TGF-β
La nivelul matricei extracelulare a țesutului pulmonar, TGF-β se află într-o structură care păstrează molecula într-o formă inactivă. Atunci când există o injurie a celulelor epiteliale, acestea exprimă receptori numiți integrine, care determină eliberarea TGF-β și activarea fibroblaștilor. αvβ6 (alpha-v beta-six) este una dintre aceste integrine, care s-a observat că înregistrează o expresie crescută în zonele unde este inițiat procesul de fibroză. STX-100 sau BG00011 este un anticorp umanizat care în studii preclinice a demonstrat activitate anti-fibrotică.
În cadrul ATS 2018 s-au prezentat rezultatele unui studiu de fază 2A care a arătat că BG00011 are un profil bun de siguranță și planurile pentru fazele 2B și 3 ale trialului sunt în derulare.
LOXL2
Una dintre cele mai importante descoperiri din ultimele decenii este că fibroza progresează în absența inflamației. Țesutul cicatricial poate recruta și activa și alte celule care întrețin transformarea plămânului, ceea ce explică evoluția bolii. Pentru rigiditatea tisulară care apare în FPI s-a dezvoltat o moleculă, simtuzumab, care are ca țintă LOXL2 – o enzimă responsabilă de apariția legăturilor dintre colagen și elastină. Enzima înregistrează valori crescute în plămânii bolnavilor de FPI, iar în studii pe modele animale s-a observat că blocarea LOXL2 determină diminuarea procesului de fibroză. Nivelul de LOXL2 din sânge se corelează cu progresia bolii.
Cu toate acestea un studiu de fază II a arătat că simtuzumab nu a atins obiectivele primare și nu a demonstrat o îmbunătățire semnificativă, ceea ce sugerează că LOXL2 nu reprezintă o țintă terapeutică unică.
Au fost studiați însă și compuși din familia LOX și proteine LOX-like (LOXL), observându-se o expresie crescută a acestor molecule la nivelule celulelor epiteliale ale bolnavilor cu FPI comparativ cu subiecții sănătoși. LOXL2 s-a detectat la nivelul focarelor de transformare fibroblastică în timp ce LOXL 1 și 4 s-au asociat cu expresii nesemnificative. Cercetările se îndreaptă asupra identificării de medicamente care pot ținti simultan mai multe componente ale familiei LOX/LOXL.
Terapia cu celule stem
Celulele stem mezenchimale sunt studiate în mai multe studii clinice pentru tratamentul FPI. Astfel ar putea fi generat un nou țesut pulmonar care poate restabili funcția pulmonară. Celulele stem mezenchimale pot determina reducerea inflamației care apare în plămân determinând scăderea procesului de fibroză. Acestea pot fi obținute din măduva osoasă adultă, sânge din cordonul ombilical sau placentă.
Un studiu de fază I, desfășurat la Prince Charles Hospital, Brisbane a înrolat pacienți cu FPI care au primit doze în concentrații scăzute și crescute de celule stem mezenchimale. Datele studiului au demonstrat că terapia este eficientă și la 6 luni după tratament nu se observă o agravare a bolii.
Studiul AETHER, desfășurat la Universitatea din Miami a obținut rezultate similare. După o monitorizare de 60 de săptămâni terapia cu celule stem a fost bine tolerată și nu s-au înregistrat efecte secundare din cauza tratamentului. Sigurul studiu de fază I/II care înrolează în prezent pacienți se desfășoara în China și își propune izolarea de celule stem din bronhiile subiecților. Ulterior aceștia vor primi tratament cu celulele crescute în culturi printr-o injecție direct în zona afectată de FPI. Primele rezultate sunt așteptate în decembrie 2018, dar până la posibila aprobare a unor astfel de terapii vor mai trece câțiva ani.
Citește și
- Fibroza pulmonară idiopatică: o boală mai puțin cunoscută, dar cu o mortalitate mai mare decât multe forme de cancer
- Recunoașterea „sunetelor specifice fibrozei pulmonare idiopatice” – cheia pentru diagnosticul precoce și eficacitatea tratamentului. Ascultă și tu!

