State of Innovation 2019: valoarea adăugată a medicamentelor biologice în sistemul de sănătate din România
Biotehnologia a condus la progrese majore în numeroase arii medicale, cu impact asupra a milioane de pacienți din întreaga lume. Inovația în acest domeniu a fost chiar răsplătită cu premiu Nobel pentru Chimie în 2018. Biotehnologia și medicamentele biologice au reprezentat un subiect important pe agenda evenimentului „Știința întâlnește Politicienii”, realizat de Centrul pentru Inovație în Medicină în parteneriat cu Comisia pentru Sănătate și Familie din Camera Deputaților și Comisia de Sănătate din Senat. Cu ocazia acestui eveniment a fost prezentat Raportul Anual State of Innovation, iar direcțiile de dezvoltare ale biotehnologiei au reprezentat subiectul unui capitol din raport.
Despre biotehnologie
Biotehnologia reprezintă un domeniu de vârf în știința modernă, care implică utilizarea de organisme vii pentru a obține substanțe utile oamenilor, sau pentru a efectua procese delicate, utile în diferite industrii. Astăzi este un domeniu inovator, însă începuturile biotehnologiei, din perioada antică, constau în încrucișarea selectivă a plantelor și animalelor sau utilizarea fermentației pentru a crea alimente ( de exemplu pâine, oțet și, desigur, băuturi alcoolice).
În cadrul medicinei, biotehnologia are un rol esențial în crearea metodelor diagnostice și terapeutice moderne, printre care și medicamentele biologice.
Medicamentele biologice
Un biologic este definit drept un medicament care conține cel puțin o substanță activă produsă de un organism viu. Acesta diferă radical de medicamentele obișnuite, obținute prin sinteză chimică, care au adesea structuri moleculare cu o complexitate scăzută sau moderată. Medicamentele biologice, fiind produse de organisme vii, sunt de sute sau chiar mii de ori mai voluminoase și complexe decât substanțele de sinteză. Au structuri și funcții similare cu substanțe care se găsesc în mod natural în organismul nostru, precum hormonii, enzimele sau anticorpii.
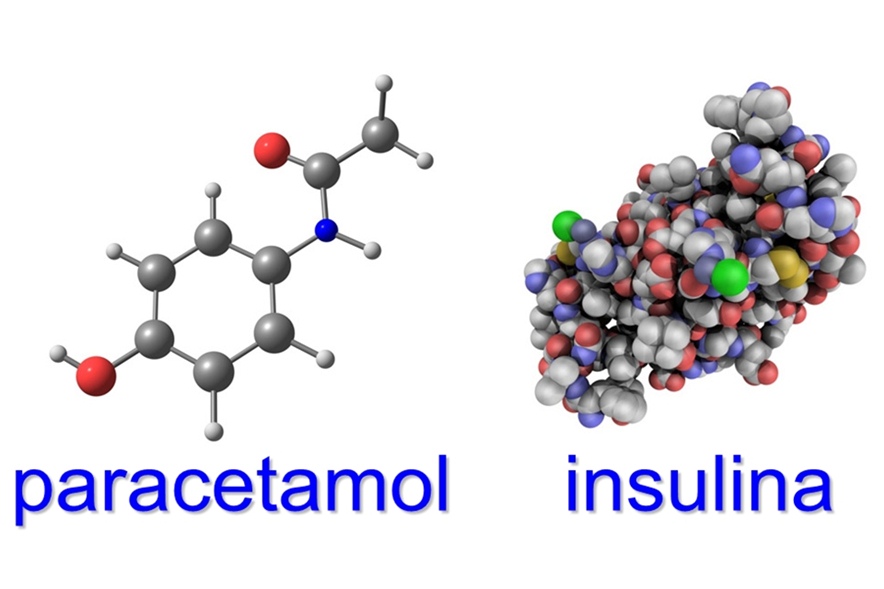
Procesul biotehnologic care sta la baza medicamentelor biosimilare
Spre deosebire de medicamentele obișnuite, care sunt produse prin procedee de sinteză chimică, medicamentele biologice sunt produse de către organisme vii. Astăzi se folosesc bacterii sau linii celulare modificate, care provin de la diferite mamifere. Producerea unui medicament biologic începe în laborator, unde gena corespunzătoare substanței active este introdusă în micro-organismul cu rol de fabrică. Ulterior, micro-organismele astfel modificate sunt introduse în bioreactor, unde se multiplică și produc substanța activă. După ce masa de celule și-a încheiat ciclul, care durează aproximativ 2 săptămâni, lichidul din bioreactor este extras și începe un procedeu complex de purificare.
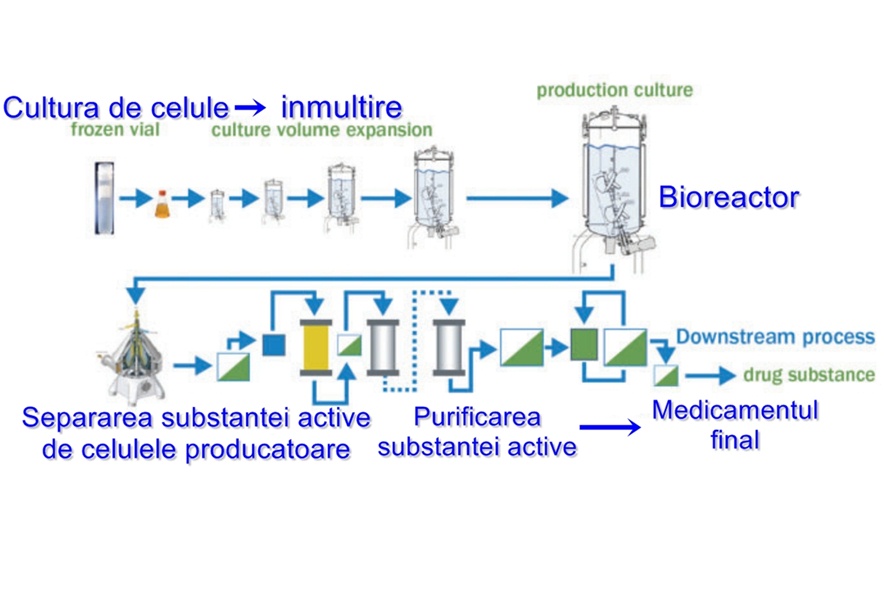
Acest proces îndelungat este monitorizat permanent pentru a asigura un nivel optim de calitate. Fiind produse cu ajutorul unor organisme vii, efectele terapiilor biologice depind de numeroase variabile, precum liniile celulare folosite sau tehnica de laborator. Față de medicamentele de sinteză, a căror producție implică circa 50 de verificări de calitate, o linie de producție biologică trece prin aproximativ 250 de testări.
Terapiile biologice și biosimilare
Un biosimilar reprezintă o terapie biologică înalt similară unei terapii biologice de referință, deja aprobate, care este echivalent din punct de vedere al calității, eficacității și siguranței. Datorită modului de producere, un biosimilar nu poate fi identic, ci are o structură similară medicamentului său de referință.
Dacă în fabricarea biologicului original atenția se îndreaptă asupra siguranței și eficacității medicamentului în studiile clinice, pentru biosimilare se realizează analize care să confirme similaritatea cu originalul – structură, compoziție, activitate in vitro.
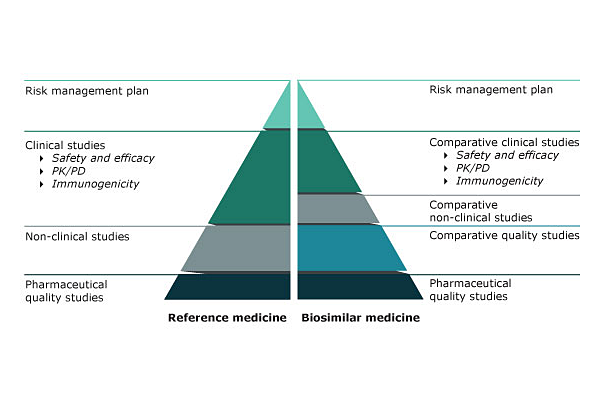
Această succesiune de studii este strict reglementată de Agenția Europeană a Medicamentului (EMA), care a dezvoltat o procedură riguroasă de aprobare a biosimilarelor, pentru a asigura aceleași efecte benefice pentru pacienți. În urma aprobării, monitorizarea biosimilarului este strictă, pentru a detecta posibile reacții adverse necunoscute până în acel moment.
Momentul actual
În prezent, peste 20% dintre medicamente sunt produse prin biotehnologie, iar în următorii ani proporția va ajunge chiar la 50%.
La nivel mondial, peste 350 de milioane de oameni beneficiază de efectele acestor molecule, și tot mai multe domenii medicale utilizează medicamente biologice. Printre medicamentele biologice frecvent utilizate există anticoagulante utilizate în cazul unui infarct miocardic acut, diferite tipuri de insulină pentru tratamentul diabetului, vaccinuri contra bolilor virale precum varicela, sau chiar medicamente care împiedică apariția orbirii în cadrul unor boli rare oftalmologice. Însă, domeniile medicale care au beneficiat cel mai mult în urma introducerii medicamentelor biologice sunt oncologia și reumatologia.
În cazul oncologiei, terapiile biologice au adus progrese remarcabile, în special în subtipuri tumorale cu un prognostic negativ, precum melanomul sau cancerul pulmonar. Este vorba de o serie de categorii terapeutice: imunoterapiile, care cresc eficiența luptei sistemului imun contra tumorii, terapiile celulare CAR-T, anticorpii țintiți care inhibă în mod specific un mecanism de proliferare al tumorii, vaccinuri și molecule imuno-modulatoare.
În cazul reumatologiei, cele mai mari progrese s-au înregistrat în tratamentul poliartritei reumatoide. Utilizarea de anticorpi monoclonali, precum adalimumab, a condus la o proporție ridicată de control al bolii și o calitate a vieții semnificativ îmbunătățită.
Arii de dezvoltare în biotehnologie
În România, au fost demarate inițiative care își propun alinierea practicii medicale în ceea ce privește medicamentele biologice și facilitarea adoptării acestora în sistemul de sănătate.
Atât societățile profesionale, cât și asociații de pacienți au elaborat documente de poziție, care prezintă succint principiile de utilizare ale acestor medicamente.
Documentul de poziție semnat de nouă organizații medicale se bazează pe directivele europene care privesc biotehnologia, și îndeamnă la:
- Identificarea riguroasă a terapiilor biologice: prescrierea pe denumire comercială, schimbarea unui biologic cu un biosimilar atent monitorizată și reglementată, circuit transparent de prescriere a acestor substanțe;
- Rigoare în practica medicală: studii extensive care preced extinderea indicațiilor, monitorizarea pentru siguranță în urma aprobării și punerii pe piață, farmacovigilența și atenția crescută la potențialul imunogenic.
Asociațiile de pacienți au trasat cinci direcții prioritare în acest domeniu, menite să îmbunătățească accesul și eficacitatea acestor terapii pentru fiecare pacient:
- Importanța informării pacienților asupra medicației biologice pe care o primesc;
- Transparența cu privire la studiile clinice realizate;
- Păstrarea deciziei de alegere a tratamentului optim pentru fiecare pacient la nivelul medicului;
- Asigurarea accesului pe lista medicamentelor compensate în ritm accelerat și simplificat pentru medicamentele biologice care își demonstrează fără echivoc valoarea în studiile clinice;
- Monitorizarea atentă a medicației și stimularea raportării efectelor adverse.

În plus, o serie de evenimente a catalizat apariția recomandărilor pentru acțiune, care pot fi găsite în Raportul State of Innovation 2019. Este vorba despre simpozionul „Valoarea adăugată a biotehnologiei și medicamentelor biologice în sistemul de sănătate din România”, eveniment care a condus la constituirea Grupului de Experți “Biotehnologie și Medicamente Biologice”; și prima Întâlnire a Grupului, în care s-a discutat poziția actuală a României în domeniul biotehnologiei.
Mai multe detalii despre aceste evenimente, aici și aici.

Recomandări pentru acțiune
- Adaptarea cadrului legislativ (acte normative și norme metodologice) pentru păstrarea și consolidarea deciziei medicale în privința prescrierii tratamentului biologic, precum și în privința schimbării tratamentului, în detrimentul criteriilor economice sau care țin de sistemul de achiziții publice;
- Creșterea accesului pacienților români la biotehnologie prin dezvoltarea Fondului “Inovație în Sănătate”, care să pună la dispoziţia pacienţilor cele mai noi metode terapeutice aprobate de Agenția Europeană a Medicamentului (EMA) și care nu sunt încă disponibile prin sistemul de compensare din România;
- Promovarea unor programe de informare și educare pentru dezvoltarea în teritoriu a competențelor în privința prescrierii medicamentelor biologice și a managementului bolnavilor, în acele arii terapeutice în care folosirea medicamentelor biologice este în fază incipientă.
CITEȘTE ȘI:
- Săptămâna Europeană a Biotehnologiei. Ce sunt medicamentele biologice?
- Săptămâna Europeană a Biotehnologiei. Ce este biotehnologia și cum s-a inserat în viața noastră de zi cu zi?
- Premiul Nobel pentru Chimie 2018: aplicarea principiilor lui Darwin în eprubete și dezvoltarea de medicamente biologice în beneficiul întregii umanități

