Cum se transformă plămânii bolnavilor de fibroză pulmonară idiopatică?
Să fie inflamația punctul zero care declanșează apariția fibrozei? Dacă ar fi așa, atunci de ce bolnavii au un răspuns nesemnificativ la medicamentele antiinflamatoare și imunomodulatoare? Există alte modificări în plămân care să justifice apariția fibrozei pulmonare idiopatice (FPI)? Două teorii încearcă să explice mecanismele din spatele acestei boli.
Repararea țesuturilor este aberantă în FPI – agresiunile repetate realizate de triggeri necunoscuți din mediu sau endogeni generează apariția de cicatrici în plămân.
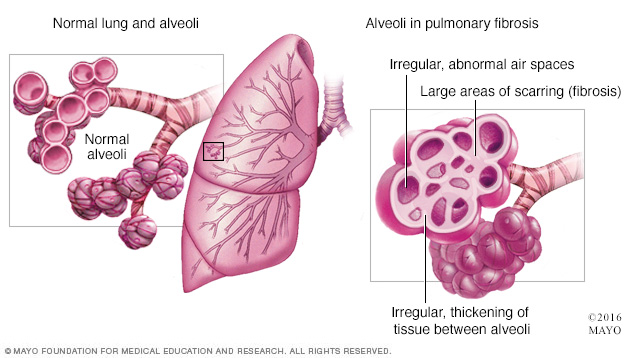
Pentru a înțelege modificările caracteristice FPI trebuie să înțelegem rolul unor celule cheie din țesutul pulmonar.
Fibroblastul este o celulă ce sintetizează colagen și componente ale matrixului extracelular, adică totalitatea moleculelor ce realizează o rețea, un schelet care conferă structura de susținere caracteristică țesuturilor.
Miofibroblastul reprezintă un tip de celulă ce exprimă un fenotip de graniță între fibroblast și celula musculară. Ultrastructural, miofibroblastul se aseamănă cu o fibră musculară netedă. Ele au rolul de a se contracta și într-o leziune poate grăbi procesul de vindecare prin apropierea marginilor afectate. Fibroblastele se pot transforma în miofibroblaste. După ce și-au îndeplinit rolul, intră în apopotoză (moarte celulară programată).
Din ce este format epiteliul alveolar?
Celule alveolare de tip I care sunt plate (scuamoase) și subțiri pentru a crește suplimentar suprafața fiecărei celule, fiind implicate în procesul de schimb de gaze între alveolă și sânge.
Celulele alveolare de tip II sunt mult mai puține, având rolul de a secreta surfactantul, o substanță necesară scăderii tensiunii superficiale. Datorită acestei substanțe, alveolele nu se închid în timpul expirului.
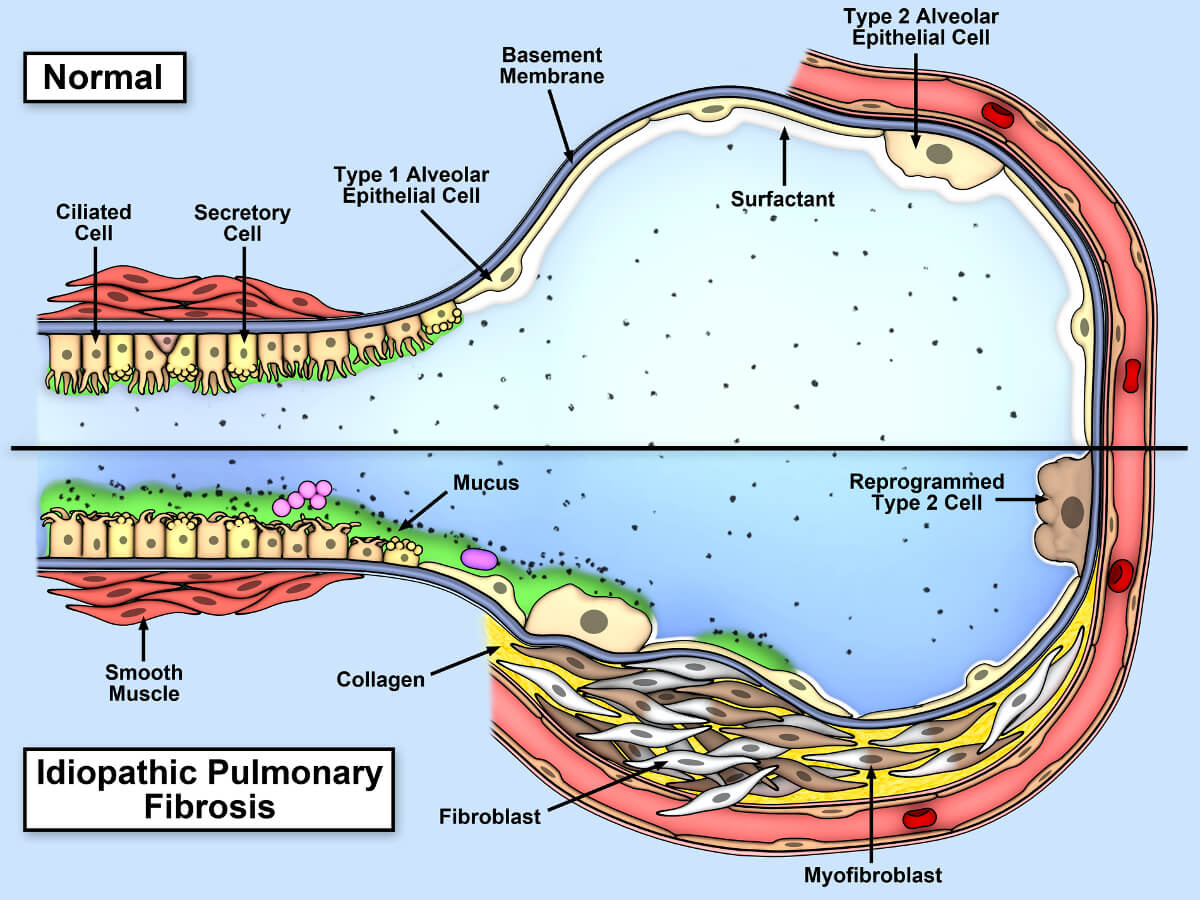
Agresiunea repetată asupra acestor celule epiteliale alveolare (pneumocite) se consideră că inițiază apariția țesutului fibrotic în plămân. În momentul distrugerii pneumocitelor de tip I, pneumocitele de tip II încep să prolifereze pentru a acoperi membrana bazală care rămâne expusă. În mod normal, repararea țesutului presupune moartea celulelor de tip II care s-au hiperplaziat, iar celulele care rămân se vor transforma în pneumocite de tip I.
Celulele alveolare activate eliberează factori fibrogenici cum sunt citokinele și factorii de creștere:
- TNF alfa (tumor necrosis factor-α)
- TGF beta (transforming growth factor-β)
- PDGF (platelet-derived growth factor)
- ET-1 (endothelin-1)
Aceste molecule sunt implicate în migrarea fibroblastelor și transformarea fibroblastelor în miofibroblaste. Cele două tipuri de celule – fibroblastele și miofibroblastele – sunt celulele caracteristice efectoare în procesul de fibrogeneză.
La un om sănătos, pentru ca repararea tisulară să fie normală, miofibroblastele trebuie să intre în moarte celulară programată după ce și-au îndeplinit rolul. În FPI acest lucru nu se întâmplă și apare o producție exagerată de țesut cicatricial care restricționează funcția pulmonară.
Sub acțiunea diferiților factori (fumatul, poluarea atmosferică, infecții virale, boala de reflux gastro esofagian, etc) și prin intermediul TGF beta ( transforming growth factor beta), fibroblastele se acumulează în ariile lezate și se transformă în miofibroblaste care secretă colagen și proteine.
Ce spun cele două teorii?
Se considera în trecut că inflamația este punctul de plecare pentru FPI. Totuși, răspunsul la terapia antiinflamatoare este slab la acești bolnavi.
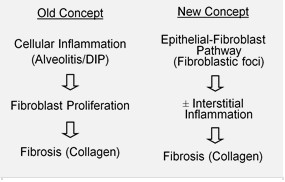
Teoriile actuale arată că focarele de transformare fibroblastică apar înaintea fenomenului inflamator. Aceste teorii noi sunt susținute indirect, prin prezentarea clinică a bolii: debutul lent, progresia de-a lungul mai multor ani, frecvența apariției exacerbărilor acute și lipsa de răspuns la terapia imunosupresivă. Mai multe medicamente care au ca țintă activarea fibroblastelor sau sinteza matricei extracelulare sunt evaluate în prezent.
Prin urmare, apoptoza în exces a celulelor epiteliale alveolare și rezistența fibroblastelor și miofibroblastelor la apoptoză contribuie la progresia fibrozei din FPI.
Studiile au arătat un deficit al prostaglandinei E2 în țesutul pulmonar la cei cu FPI, ceea ce crește sensibilitatea pneumocitelor la apoptoză.
De asemenea, apar tot mai multe argumente care susțin o baza genetică mai puternică decât s-a crezut în apariția FPI. Mutații la nivelul telomerazei (o enzimă implicată în formarea cromozomilor) se asociază cu FPI (forma familială) și au fost propuse teorii care pun pierderea celulelor epiteliale alveolare pe seama unei activități anormale a telomerazei.
Gena care codifică mucina 5B a fost asociată atât cu formele sporadice, cât și familiale de FPI. Caveolina-1 ar limita producerea de matrix extracelular indus de TGF beta, iar la cei cu FPI expresia caveolinei este redusă.
Puteți urmări în videoclipul de mai jos o animație a mecanismului de apariție a FPI:
Articole similare
- Fibroza pulmonară idiopatică: o boală mai puțin cunoscută, dar cu o mortalitate mai mare decât multe forme de cancer
- 200 de afecțiuni ale plămânului au simptome similare, dar cauze diferite. Să înțelegem bolile interstițiale pulmonare
- Recunoașterea „sunetelor specifice fibrozei pulmonare idiopatice” – cheia pentru diagnosticul precoce și eficacitatea tratamentului. Ascultă și tu!
- O boală de cauză necunoscută – fibroza pulmonară idiopatică. Care sunt factorii de risc?

