Primele date clinice care susțin eficacitatea și siguranța editării genice in vivo prin CRISPR-Cas9 pentru tratamentul amiloidozei ereditare mediată de transtiretină
O terapie care folosește sistemul de editare genică CRISPR-Cas9 ar putea reprezenta prima soluție curativă pentru amiloidoza ereditară mediată de transtiretină (ATTR – transthyretin amyloidosis). Rezultatele interimare dintr-un studiu de fază I, publicate pe 26 iunie în New England Journal of Medicine, arătau că după o singură doză a terapiei candidate NTLA-2001, valorile serice ale transtiretinei au fost reduse cu până la 87%, mai mult decât ceea ce se poate obține în prezent prin terapia standard.

NTLA-2001 se bazează pe o tehnologie descoperită de Emmanuelle Charpentier și Jennifer A. Doudna, laureatele Premiului Nobel pentru Chimie din 2020: editarea genică prin CRISPR-Cas9. O astfel de terapie este complet diferită de tratamentele convenționale deoarece permite eliminarea cauzei bolii – anomalii la nivelul genei TTR – printr-o tehnologie de mare precizie. Editarea genică are efecte permanente, eliminând necesitatea tratamentelor cronice.
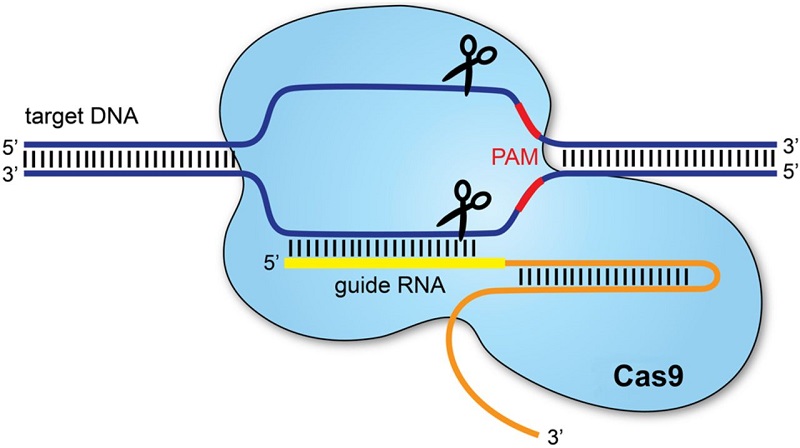
Terapia dezvoltată de Intellia și Regeneron utilizează nanoparticule lipidice pentru administrarea sistemului de editare genică la nivelul celulelor hepatice: ARN-ul mesager care codifică proteina Cas9 și molecula de ARN ghid care țintește gena TTR.
După realizarea studiilor preclinice in vivo și in vitro a urmat testarea siguranței și a dozei optime într-un studiu de fază I care a inclus 6 pacienți cu amiloidoză ereditară mediată de transtiretină cu polineuropatie. S-a observat un efect dependent de doză în urma administrării terapiei. La 28 de zile s-au înregistrat următoarele rezultate:
- S-a obținut o reducere de 52% a valorilor serice ale transtiretinei la 3 pacienți care au primit o doză scăzută (0.1 mg/kg);
- 3 pacienți care au primit o doză mai mare, de 0,3 mg/kg, au obținut o reducere medie a transtiretinei serice, de 87%;
- Unul dintre pacienți a obținut o reducere a valorilor transtiretinei de 96%.
În prezent, se desfășoară înrolarea unei noi cohorte pentru evaluarea unei doze și mai mari, de 1 mg/kg. Astfel, se urmărește identificarea dozei optime care conduce la obținerea unei reduceri semnificative a proteinei patologice și la efecte clinice favorabile, cu un profil bun de siguranță. Se estimează că la finalul anului ar putea începe faza II a studiului. Studiul va înrola aproximativ 38 de pacienți și se desfășoară în Marea Britanie și în Noua Zeelandă. După finalizarea fazei I vor fi evaluați și pacienți cu cardiomiopatie.
Amiloidoza mediată de transtiretină este o boală rară, care apare la persoanele care prezintă anomalii la nivelul genei TTR. Aceasta codifică transtiretina, o proteină care în mod normal transportă tiroxina (un hormon tiroidian) și retinolul (vitamina A) în sânge și lichidul cefalorahidian. Ficatul produce cea mai mare parte a proteinei circulante.
În cazul ATTR, celulele hepatice produc proteine patologice care se acumulează în organism și determină tulburări ale mai multor sisteme și organe (cord, rinichi, tract gastrointestinal, ochi). Principalele forme în care se prezintă boala sunt polineuropatia și cardiomiopatia, caracterizate prin depozite de amiloid alcătuit din acumularea anomală a transtiretinei. În cazul polineuropatiei, fibrilele de amiloid se depozitează la nivelul nervilor periferici și ai sistemului nervos vegetativ. Depozitele de amiloid pot apărea și la nivelul inimii, ceea ce conduce la cardiomiopatie restrictivă și în final la insuficiență cardiacă. Simptomele sunt nespecifice și pot fi confundate cu cele ale altor afecțiuni.
Sistemul de editare CRISPR-Cas9
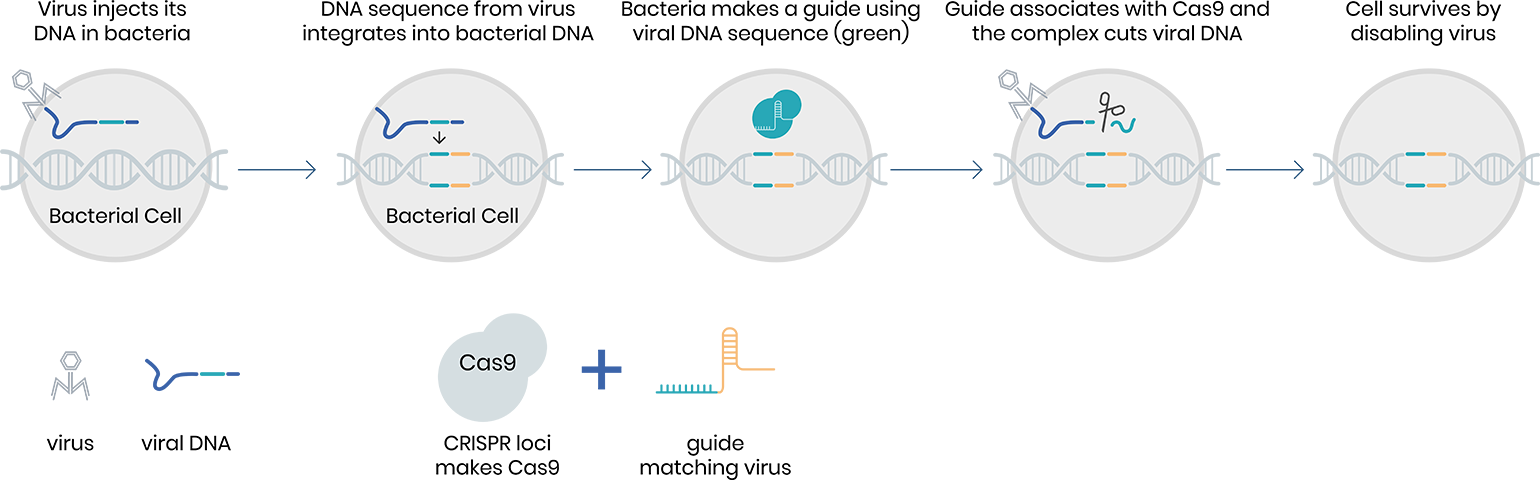
Tehnologia CRISPR-Cas9 a fost adaptată de la un mecanism de apărare identificat la bacterii. În momentul în care un virus atacă o bacterie, aceasta poate recunoaște microorganismul prin copierea unor segmente din materialul genetic al virusului și păstrarea lor sub forma unor fragmente repetitive de ADN. Dacă virusul va ataca din nou bacteria, aceasta folosește matricea ADN pentru a-l recunoaște și produce molecule ARN specifice care funcționează ca un ghid. Apoi, enzima Cas9 intervine pentru a inactiva virusul.
Sistemul CRISPR-Cas 9 este utilizat după același principiu și în laboratoare. Se obține un fragment de ARN ghid care recunoaște o secvență specifică de ADN. Enzima Cas9 „taie” molecula de ADN exact la locul specificat de ARN. Odată ce fragmentul de ADN de interes este tăiat se folosește mecanismul celular de reparare a ADN-ului pentru a se adăuga, a se elimina sau înlocui fragmente de material genetic.

CRISPR-Cas9 este una dintre cele mai importante descoperiri ale secolului 21, dezvoltată ca un instrument de editare genică în 2012. Aplicațiile s-au extins rapid, de la studierea mecanismelor implicate în patologia umană, descoperirea de medicamente până la influențarea altor domenii precum agricultura, alimentația, modificările climatice.
Tehnologiile de editare genomică reprezintă unul dintre cele mai importante domenii de cercetare medicală ale momentului. Dacă în 2011 erau mai puțin de 100 de lucrări publicate asupra CRISPR, în 2018 se înregistrau peste 17.000.
Există două abordări principale în utilizarea CRISPR în scop terapeutic. Editarea genică ex vivo implică extragerea de celule umane, modificarea în laborator și reintroducerea lor în organismul pacientului. Editarea genică in vivo implică modificări directe în organismul pacientului.
La începutul anului 2020, un pacient cu o afecțiune genetică care provoacă orbire (amauroza congenitală Leber) a devenit prima persoană care a primit o terapie CRISPR-Cas9 administrată direct în organism. Terapia EDIT-101 este evaluată în studiul clinic BRILLIANCE, primul în se care utilizează mecanismul de editare genomică CRISPR in vivo pentru tratamentul amaurozei congenitale Leber, cu mutație a genei CEP290. Studiul este realizat de Editas Medicine, o companie fondată de Jennifer Doudna. În prezent, tehnologia este evaluată în studii clinice și pentru alte afecțiuni precum anemia falciformă, hemofilia sau diferite forme de cancer.
Deși CRIRSP-Cas9 a devenit într-un timp scurt un un instrument care a revoluționat cercetarea și practica medicală, există multiple provocări care țin de aspecte etice, sociale și de reglementare. Pe 12 iulie, Organizația Mondială a Sănătății a emis primele recomandări privind utilizarea tehnologiilor de editare genomică în intervențiile de sănătate publică.
O nouă generație de produse biofarmaceutice
Timp de mulți ani, singurele soluții pentru ATTR erau reprezentate de transplantul hepatic sau medicamente generice care stabilizează proteina transtiretina. Odată cu dezvoltarea genomicii noi tipuri de agenți terapeutici sunt explorați în patologii pentru care opțiunile terapeutice erau limitate. Produse biotehnologice inovatoare, bazate pe acizi nucleici (ADN, ARN) aduc schimbări majore în medicină și sunt complet diferite de abordările clasice în care se folosesc molecule mici, ce acționează la nivel de proteine.
Principiul de bază în terapiile care folosesc acizi nucleici este inhibarea expresiei genelor de la nivel ADN sau ARN, blocând producția unei proteine anormale relevante pentru o anumită patologie. Terapiile bazate pe acizi nucleici sunt un subiect important de cercetare iar în ultimii ani pătrunderea acestora în practică este accelerată. Două categorii importante sunt terapiile care funcționează prin interferența ARN și oligonucleotidele antisens, acestea fiind explorate și în tratamentul amiloidozei ereditare.
În 2018, FDA a aprobat un număr record de terapii personalizate, acest an marcând și prima aprobare a unui tratament care funcționează prin mecanismul de interferență ARN: patisiran a primit aprobare pentru ATTR cu polineuropatie. Interferența ARN este un mecanism prin care este controlată expresia genelelor. Tratamentul se administrează printr-o injecție intravenoasă o dată la 3 săptămâni și conduce la reduceri ale TTR de 81%. O altă terapie este inotersen (din categoria de oligonucleotide antisens) care reduce valorile circulante ale proteinei codificate de TTR de până la 71%. Aceasta se administrează prin injecții subcutanate săptămânale.
Citește și:
- CRISPR/Cas9: promisiunile și provocările editării genice în medicină. Care sunt aplicațiile practice?
- Premiul Nobel pentru Chimie 2020: dezvoltarea tehnologiei de editare genomică CRISPR-Cas9

