Tehnologia de editare genomică CRISPR, utilizată pentru prima oară in vivo la pacienți în tratamentul unei forme moștenite de orbire
Cercetările în domeniul editării genomice au fost aplicate în premieră la pacienți umani la Casey Eye Institute, Universitatea Oregon Health & Science din Portland, în cadrul studiului clinic BRILLIANCE, utilizând tehnologia CRISPR-Cas9 în încercarea de a trata amauroza congenitală Leber, o formă moștenită de orbire.
„Avem cu adevărat potențialul de a reda vederea pacienților nevăzători și credem că putem iniția un nou set de tratamente bazate pe modificarea ADN-ului”, a declarat Charles Albright, cercetător științific principal la Editas Medicine, Cambridge, Massachusetts.
Analiza eficienței acestei terapii în redarea vederii pacientului poate dura până la o lună. Dacă primele încercări se dovedesc a fi sigure, această terapie ar putea fi testată în continuare la 18 pacienți copii și adulți.
Editarea genomică CRISPR în amauroza congenitală Leber
Tehnologia CRISPR-Cas9 este însă un instrument inovativ de localizare și tăiere a unor fragmente de ADN și a fost primită cu entuziasm în lumea cercetării medicale datorită faptului că este o metodă mai ieftină, mai rapidă şi mai precisă decât alte tehnologii de editare a genomului utilizate în trecut.
Studiul clinic BRILLIANCE este primul care utilizează mecanismul de editare genomică CRISPR direct în interiorul organismului uman în tratamentul amaurozei congenitale Leber, cu mutație a genei CEP290.
„Acest studiu este un moment istoric pentru știință, pentru medicină și, cel mai important, pentru oamenii care trăiesc cu această afecțiune”, a declarat Cynthia Collins, președinte și director executiv al Editas.
„Acest studiu marchează o nouă eră în medicină, utilizând o tehnologie care permite editarea ADN-ului mult mai ușor și eficient”, a declarat Dr. Jason Comander, medic chirurg oftalmolog la Massachusetts Eye and Ear din Boston, un alt spital care plănuiește să înroleze pacienți în studiu.
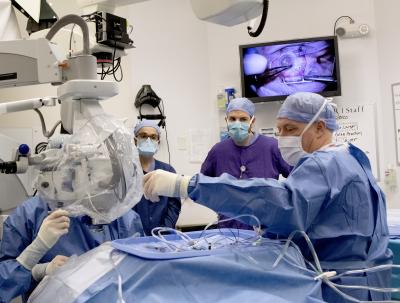
Sursa foto: Oregon Health & Science University
Intervenția se realizează într-o operație de o oră, sub anestezie generală. Cu ajutorul unui tub de grosimea unui fir de păr, medicii injecteză în globul ocular trei picături de fluid ce conține „aparatul” de editare genomică chiar sub retină.
„O dată cu editarea ADN-ului unei celule, această modificare este permanentă și va persista toată viața pacientului, deoarece celulele retiniene nu se divid”, a menționat un lider din studiu, Dr. Eric Pierce, de la Spitalul Massachusetts, Boston.
Medicii consideră că trebuie să corecteze între 10% și 30 % dintre celule pentru a reda vederea pacienților.
„Testele efectuate până acum în laborator au permis corectarea a până la jumătate dintre celule cu ajutorul acestui tratament”, a adăugat Albright.
Intervenția în sine are un risc scăzut de complicații, conform medicilor. Infecțiile și sângerarea sunt complicații relativ rare.
Ce este amauroza congenitală Leber?
Amauroza congenitală Leber (LCA) este întâlnită în 2 până la 3 cazuri din 100,000 de nou-născuți și este una dintre cele mai frecvente cauze de cecitate la copii. Este o boală ce afectează retina și duce la deficiență vizuală severă încă din copilărie.
Această afecțiune poate rezulta din mutații la nivelul a cel puțin 14 gene, toate necesare pentru o vedere normală. Fiecare dintre aceste gene joacă un rol important în dezvoltarea și funcționarea retinei. Mutații la nivelul oricărei gene din acest grup conduc la anomalii în dezvoltarea și funcționarea retinei, și deci la pierderea timpurie a vederii.
Cele mai frecvente mutații asociate acestei boli sunt la nivelul genelor CEP290, CRB1, GUCY2D și RPE65, în timp ce alte mutații sunt responsabile de procente mai mici dintre cazuri. Profilul mutațional al acestei afecțiuni diferă în funcție de populația de studiu și există între 25 până la 50% situații în care cauzele bolii rămân necunoscute.
Amauroza congenitală Leber se transmite genetic în cele mai multe cazuri pe model de transmitere autozomal recesivă (boala necesită mutații la nivelul ambelor copii ale genei afectate).
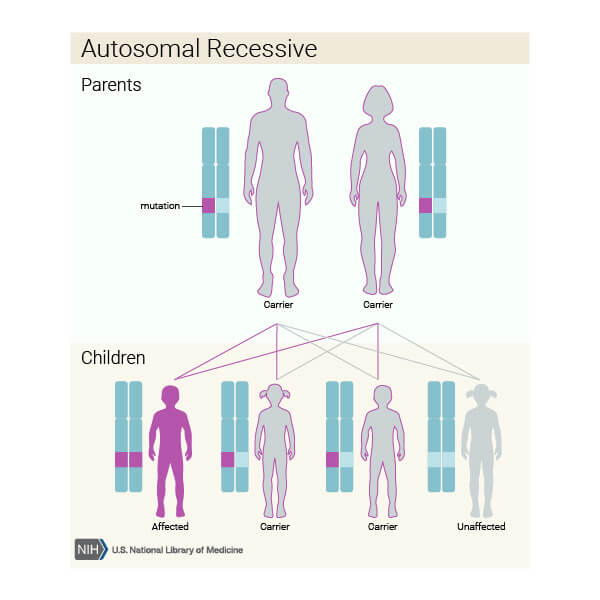
Părinții indivizilor cu boală autozomal recesivă sunt în general purtători sănătoși, adică dețin doar o copie a genei mutate, dar nu manifestă semne și simptome ale bolii. Sursa foto
Există și situații în care boala este transmisă genetic autozomal dominant (o singură copie a genei alterate este suficientă pentru ca boala să se manifeste), spre exemplu când mutațiile sunt la nivelul genelor CRX sau IMPDH1.
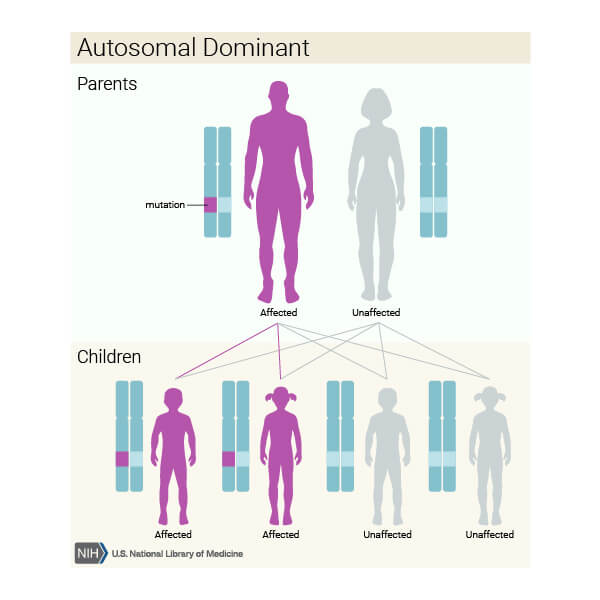
Doi părinți (unul bolnav și unul sănătos) prezintă un risc de 50% de a transmite boala urmașilor și 50 % șanse de a da naștere unui copil sănătos. Sursa foto
În alte cazuri, amauroza congenitală Leber apare de novo, prin mutații spontane, la persoane fără istoric familial pozitiv pentru o astfel de afecțiune.
Modalitățile de tratament sunt limitate și includ în general măsuri suportive. În anul 2017, Luxturna a devenit prima terapie genică aprobată de FDA pentru o formă genetică de orbire, indicată în tratamentul pacienților confirmați cu mutație bialelică RPE65 și care au suficiente celule viabile la nivelul retinei. Siguranța și eficacitatea terapiei a fost demonstrată prin studii clinice, iar un an mai târziu Luxturna este aprobată și în Uniunea Europeană pentru aceeași indicație.
Terapia genică în amauroza congenitală Leber
Tratamentul inovativ al acestei distrofii retiniene se bazează pe introducerea unei gene funcționale la nivelul retinei pentru a substitui funcția genei care prezintă o mutație sau care este absentă. Această genă este introdusă cu ajutorul unui vector viral modificat, în vederea scăderii capacității sale de a infecta celula, permițând totuși translația secvenței de ADN transportată într-o proteină funcțională (virusul nu are ablitatea de a se reproduce sau de a cauza boala, ci servește doar ca mijloc de pătrundere în nucleu a genei transportate).
În cazul tratamentului cu Luxturna, este introdusă o copie a genei RPE65 direct prin injectare la nivel ocular. Noua genă, o dată ajunsă la nivelul nucleului, poate produce proteinele necesare pentru o vedere normală.
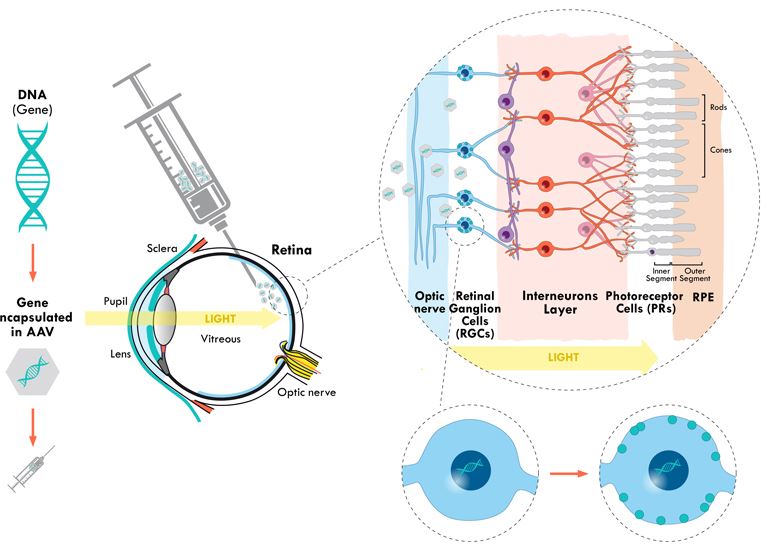
Deși progresele înregistrate prin utilizarea terapiei genice Luxturna sunt uluitoare, această metodă de tratament este rezervată unui număr mic de cazuri, întrucât se adresează unei singure gene, RPE65 (responsabilă de doar 6% până la 12% din cazurile de LCA), celelalte mutații neavând încă un tratament specific.
Totuși, aprobarea Luxturna a reprezentat un moment important în medicină, iar în urma acestor rezultate, numeroase companii și-au extins dezvoltarea în domeniul terapiilor genice, în încercarea de a acționa și asupra alor mutații responsabile de orbirea ereditară.
O altă mutație care a intrat în atenția studiilor este mutația CEP290, cel mai frecvent întâlnită în această afecțiune, responsabilă de aproximativ 20% din cazurile de LCA.
Pentru această formă a LCA terapia genică standard prin suplinirea genei defecte nu este disponibilă întrucât gena necesară este de dimensiuni prea mari pentru a fi inclusă în vectorul viral. Astfel, studiul BRILLIANCE a utilizat pentru prima oară tehnologia CRISPR în interiorul organismului uman (in vivo), în încercarea de a edita genomul la nivelul genei CEP290.
„Este o boală teribilă, iar acești pacienți nu au nicio soluție în momentul de față. Abordarea prin editare genomică este cu adevărat fascinantă. Avem nevoie de tehnologii capabile să acționeze la nivelul genelor de dimensiuni mari”, a declarat Dr. Jean Bennett, cercetător la Universitatea din Pennsylvania, care a participat la testarea terapiei genice cu Luxturna la Spitalul pentru copii din Philadelphia.
Ce este CRISPR-Cas9 și cum funcționează?
CRISPR (Clustered regularly interspaced short palindromic repeats) este un grup de tehnologii ce permit editarea genomului, având capacitatea de a înlătura sau de a adăuga diverse secvenţe specifice la nivelul ADN-ului.
Metoda CRISPR/Cas9 a fost preluată şi adaptată din lumea bacteriilor, dintr-un sistem natural al acestora de apărare împotriva genomurilor invadatoare virale, pe care le recunosc şi le distrug. Bineînţeles, bacteriile nu au motive să recunoască şi să taie alte genomuri, dar acest sistem poate fi adaptat pentru scopuri terapeutice prin substituirea elementului de recunoaştere, pentru a realiza anumite secţionări intenţionate în interiorul altor genomuri, cum ar fi cel uman.
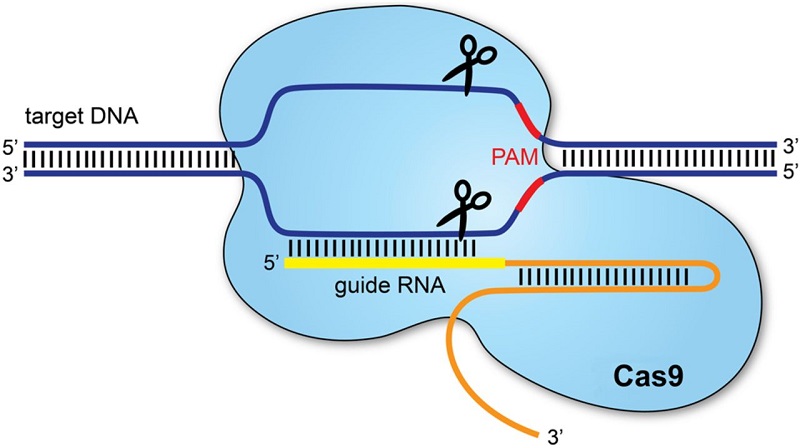
sursa: https://ep.bmj.com/content/101/4/213
Astfel, în timp ce terapia genică convențională presupune introducerea unei copii normale a genei deficiente, tehnologia CRISPR/Cas9 editează genomul, având capacitatea de a înlătura sau înlocui gena defectă.
Metoda CRISPR a mai fost utilizată în studii la om, iar metode similare de editare genică se utilizează și în prezent în tratamentul altor afecțiuni (cancere, siclemie, talasemie etc.); în aceste cazuri însă sunt prelevate celule de la pacient, editate genomic ex vivo și ulterior introduse în organism.
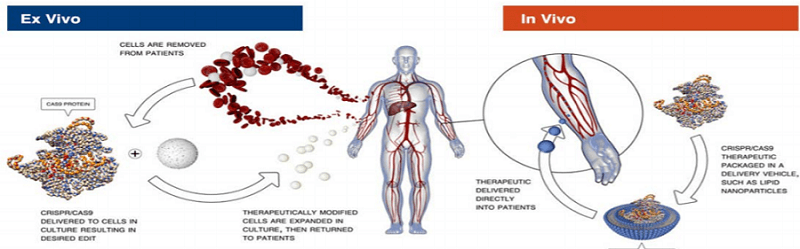
Chiar și în cazul extrem de controversat al cercetătorului He Jiankui, care a utilizat CRISPR pentru a edita embrionii în încercarea de a crea rezistență la infecția cu virusul HIV, acest lucru s-a realizat în afara organismului, în timpul fertilizării in vitro.
Prima editare genomică aplicată în interiorul organismului uman s-a realizat în anul 2017 pentru o altă afecțiune, hemofilia B, utilizând o altă metodă, nucleaza „Zinc-finger”.
CRISPR / Cas9, deşi captivantă din punct de vedere al aplicaţiilor în medicină şi cu un potențial enorm de lupta împotriva bolilor, nu este o metodă 100% precisă, ceea ce duce la importante implicații etice și morale privind editarea genomului uman.
Unul dintre cele mai mari riscuri ale editării genomice este aceea că tehnologia CRISPR poate realiza modificări nedorite la nivelul altor gene. Companiile producătoare au făcut eforturi pentru a reduce la maxim aceste riscuri și pentru a asigura acțiunea acestui tratament doar la nivelul necesar.
Editarea genică în cazul distrofiilor retiniene are avantajul de a rămâne la nivel ocular și de a nu influența alte țesuturi sau organe, astfel, în cazul în care nu funcționează, șansele de a fi afectat sunt foarte mici, ceea ce face din amauroza congenitală Leber un prim pas foarte bun în testarea terapiei de editare genomică la om. Spre deosebire de cazul cercetătorului chinez, El Jiankui, a cărui inițiativă a fost considerată neetică și a fost aspru criticată pe plan internațional în 2018, studiul BRILLIANCE a fost realizat cu aprobarea autorităților de reglementare guvernamentale.
Editarea genomului embrionar ridică o serie de provocări etice, mai ales dacă ar fi permisă utilizarea acesteia pentru a spori trăsături umane normale (cum ar fi înălțimea sau inteligența). Modificările aduse ADN-ului embrionilor se pot transmite generațiilor viitoare, spre deosebire de intervențiile efectuate în cazul studiului de față, care se adresează celulelor somatice și nu se vor transmite urmașilor.
Citește și:
- BREAKING NEWS. Luxturna, prima terapie genică aprobată de FDA pentru o boală ereditară care determină orbire
- FDA a aprobat Zolgensma, prima terapie genică pentru atrofia musculară spinală
- Cei mai importanți markeri genetici în oncologie, clasificați cu ajutorul tehnologiei CRISPR: 600 de gene, ținte terapeutice în 30 de tipuri de cancer

