FDA a aprobat Zolgensma, prima terapie genică pentru atrofia musculară spinală
Food and Drug Administration (FDA) a aprobat Zolgensma, prima terapia genică pentru copiii cu atrofie musculară spinală (AMS), cu vârste sub 2 ani. Terapia este indicată inclusiv pacienților la care nu au apărut simptomele la momentul diagnosticului. După Luxturna aceasta este a doua terapie genică aprobată pentru o boală ereditară în Statele Unite.
Zolgensma (onasemnogene abeparvovec-xioi) este o terapie administrată o singură dată în viață, iar prețul se ridică la 2,1 milioane de dolari, fiind considerat cel mai scump tratament din lume. Terapia este produsă de compania AveXis, care din 2018 face parte din grupul Novartis.
Prin introducerea unei copii funcționale a genei SMN1 în organism, tratamentul cu Zolgensma a determinat rezultate fără precedent în evoluția bolii, în cele două studii care au condus la aprobarea FDA. Dacă pentru formele grave de AMS speranța de viață nu depășea vârsta de 2 ani, cu ajutorul terapiei genice pacienții au reușit să se deplaseze, să vorbească și la 4 ani de la administrarea tratamentului.
Costurile terapiei ar putea fi distribuite pe o perioadă de 5 ani pe baza unui sistem de plată în rate. Conform unei analize de cost-eficiență, tratamentul cu Zolgensma ar costa cu 50% mai puțin decât terapia cronică necesară unui pacient pentru 10 ani folosind standardul actual.
În Europa, Zolgensma are statut prioritar (PRIME), iar până la finalul anului se așteaptă primirea aprobării și din partea Agenției Europene a Medicamentului.
Ce este atrofia musculară spinală?
Atrofia musculară spinală reprezintă o boală genetică rară caracterizată printr-un deficit al proteinei SMN (survivial motor neuron), care determină distrugerea neuronilor motori și atrofia musculară, ceea ce conduce în formele severe la afectarea unor funcții vitale. Pacienții ajung să nu se poată mișca, nu se pot alimenta corespunzător, nu pot înghiți, au dificultăți de respirație și de vorbire.
Proteina SMN este codificată de genele SMN1 și SMN2. Anomalii ale genei SMN1 determină obținerea unei proteine incomplete sau nefuncționale. Acest deficit poate fi parțial compensat de gena SMN2. Numărul genelor SMN2 variază la fiecare persoană, însă cu cât sunt prezente mai multe copii, cu atât se va produce o cantitate mai mare de proteină și boala va avea o formă mai ușoară.
Conform statisticilor din SUA, 60% dintre persoanele diagnosticate prezintă tipul 1 al bolii. Aceasta este o formă severă, în care simptomele sunt prezente la naștere sau până la vârsta de 6 luni și mai puțin de 10% dintre pacienți supraviețuiesc după vârstă de 2 ani.
În cazul AMS de tip 2, pacienții supraviețuiesc mai mult, iar tipurile 3 și 4 au debut tardiv, nu afectează atât de mult speranța de viață însă apar grade diferite de slăbiciune musculară.
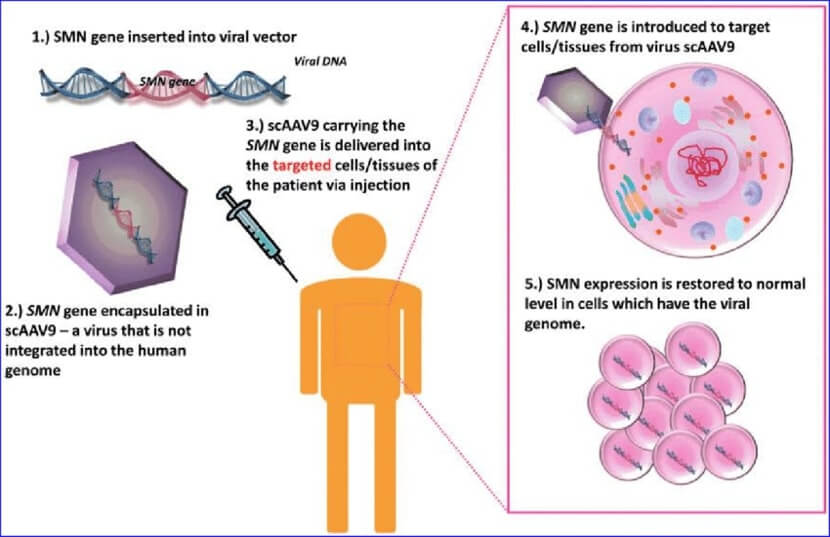
Cum funcționează Zolgensma?
Zolgensma a fost aprobată pentru pacienții cu vârste sub 2 ani cu atrofie musculară spinală, având mutație bialelică la nivelul genei SMN1. Printr-o singură administrare intravenoasă se introduce o copie funcțională a genei SMN1 în organism și se obține o expresie susținută a proteinei deficitare. Administrarea intratecală este o altă variantă, care este evaluată în prezent în studii clinice și ar permite extinderea indicației terapiei și la pacienții cu vârste mai mari.
START este unul dintre studiile care a stat la baza aprobării FDA și a demonstrat rezultate care nu se întâlneau vreodată în evoluția bolii. Funcția motorie s-a ameliorat semnificativ, pacienții au reușit să stea în șezut fără sprijin, inclusiv să meargă, să vorbească sau să se joace. Toți cei 15 copii tratați cu Zolgensma au supraviețuit și nu au mai necesitat ventilație mecanică. S-au observat rezultate susținute, efectul terapiei menținându-se la 4 ani de la administrare.
La sfârșitul anului 2018, datele din acest studiu de fază I au fost suficiente pentru ca terapia să primească statut prioritar din partea FDA, ceea ce demonstrează ritmul cu care terapiile inovatoare ajung în atenția autorităților.
Studiul de fază 3 STR1VE, care este încă în desfășurare, a urmărit siguranța și eficacitatea terapiei genice la pacienții cu vârste de sub 6 luni. Rezultatele au demonstrat creșterea supraviețuirii, îmbunătățirea semnificativă a funcțiilor motorii, datele fiind similare cu cele observate în studiul de fază I START.
Cum se poate asigura accesul la cel mai scump tratament din lume?
Următoare provocare este demonstrarea beneficiilor economice pe termen lung pe care le-ar aduce un astfel de tratament administrat o singură, în ciuda unui preț foarte ridicat. Tratamentul costă 2,1 milioane de dolari sau dacă se realizează plata pe o perioadă de 5 ani, 452 000 dolari pe an.
AveXis a lansat și un program de sprijin pentru pacienți, OneGene Program, prin care o echipă de specialiști oferă îndrumări atât în ceea privește terapia, cât și problemele financiare. De asemenea, prin intermediul programului educațional Time is Neurons se atrage atenția asupra importanței tratamentului precoce, ideal în primele două săptămâni de la tratament.
După aprobarea medicamentului, reprezentanții Novartis au explicat importanța asigurării accesului la un astfel de tratament în SUA:
„Tratamentele inovatoare precum Zolgensma ne impun să fim la fel de inovatori atunci când oferim soluții pentru accesul pacienților la acestea. Propunem un model de plată în rate pentru un tratament administrat o singură dată, care să se integreze în structura sistemului de sănătate din SUA. De asemenea, am stabilit acorduri care se bazează pe rezultatele oferite de terapie deoarece avem încredere în beneficiile pe termen lung pe care Zolgensma le poate aduce ” – David Lennon, președinte AveXis
Zolgensma este considerată o terapie cost-eficientă, având în vedere date recente oferite de ICER (Institute for Clinical and Economic Review). Conform declarației oficiale din partea Novartis, costurile pentru Zolgensma ar reprezenta:
- Cu 50% mai puțin decât costurile totale asociate îngrijirilor cronice ale unui pacient timp de 10 ani cu tratamentul actual
- Cu 50% mai puțin decât costurile pe 10 ani pentru boli genetice foarte rare în populația pediatrică
- Cu 50% mai puțin decât limita stabilită de ICER pentru cost-eficiența medicamentelor foarte rare
Prețul inițial menționat de Novartis a fost de aproximativ 5 milioane de dolari având în vedere beneficiile aduse de acest tratament cu potențial curativ administrat o singură dată. Singurul tratament disponibil până acum pentru AMS, Spinraza, a fost lansat pe piață cu un preț de asemenea ridicat, de peste 300 000 de dolari anual, aceasta fiind însă o terapie care se administrează toată viața.
Luna trecută ICER a realizat o analiză de cost-eficiență și a estimat că prețul justificat pentru Zolgensma nu ar trebui să depășească 1,5 milioane de dolari. Cu toate acestea, având în vedere noile date legate de eficacitate, la pacienții la care simptomele nu s-au instalat, președintele ICER a declarat că terapia este cost-eficientă și la o sumă de 2,1 milioane de dolari.
În 1983, Congresul SUA a aprobat documentul oficial care a reprezentat un punct important de plecare pentru cercetările în domeniul bolilor rare – Orphan Drug Act. Acesta a oferit producătorilor protecție împotriva competiției, mecanisme rapide de evaluare din partea FDA și avantaje financiare. În SUA, 56% dintre medicamentele aprobate în 2018 aveau statut de medicament orfan. Până în 2020 se estimează că terapiile cu cel puțin o indicație de medicament orfan vor reprezenta o treime din bugetul SUA. Pentru depășirea acestor provocări economice, experții sugerează că stabilirea adevăratei valori a unei terapii trebuie să se bazeze pe analize riguroase de cost-eficiență.
Competiție cu Spinraza?
Spinraza (nusinersen) a fost prima terapie modificatoare de boală aprobată în 2016 de FDA pentru tipurile 1-3 de AMS. Acesta este un tip de tratament care are rol în reglarea expresiei genice. Este o oligonucleotidă antisens sintetică, ce se leagă de ARN și poate determina obținerea unei proteine funcționale și de lungime normală.
Tratamentul, produs de Biogen, presupune injecții administrate intratecal (în lichidul cefalorahidian care înconjoară măduva spinării) pentru tot restul vieții pacienților.
Prețul ajunge la 750 000 dolari în primul an și 375 000 ulterior. Spinraza crește supraviețuirea și ameliorează funcția motorie, însă nu reprezintă un tratament curativ.
În 2017, Spinraza a fost aprobată de EMA, iar în aprilie 2018 a fost aprobată pentru compensare și în România. Cu toate acestea, abia în octombrie 2018 primii pacienți au primit tratamentul. În prezent, 50 de copii se află sub terapie cu Spinraza.
Conform unei analize Wall Street se așteaptă ca până în 2020 Spinraza să înregistreze vânzări de aproape 2,2 miliarde de dolari, iar pentru Zolgensma vânzările să ajungă la 2 miliarde de dolari.
Ce urmează?
Un sondaj care a inclus 30 de medici care tratează pacienți cu AMS a arătat că 30% dintre aceștia ar utiliza Zolgensma la un an de la lansare. De asemenea, medicii și-au arătat interesul asupra unei posibile combinații între Zolgensma și Spinraza.
Copiii care primesc tratamentul înainte de apariția simptomelor au cel mai bun prognostic și șansa la o dezvoltare cât mai aproape de normal. Screeningul nou născuților pentru AMS se impune astfel ca un nou standard. În sudul Belgiei, 60 000 de nou născuți sunt testați anual, reprezentând jumătate din totalul nașterilor. De asemenea, în 6 state din SUA a început programul de screening. În Europa, se așteaptă ca abia din 2021 să se înceapă implementarea unor astfel de programe deși experții atrag atenția asupra importanței detectării bolii cât mai devreme posibil:
„Copiii cu atrofie musculară spinală pierd neuronii motori chiar de la naștere și capacitatea de a-i trata cât mai devreme posibil este calea prin care se pot obține beneficiile maxime ale terapiei” – David Lennon, AveXis
Citește și
- BREAKING NEWS. Luxturna, prima terapie genică aprobată de FDA pentru o boală ereditară care determină orbire
- BREAKING NEWS. Vindecarea hemofiliei A și B prin terapii genice este mai aproape de a deveni realitate

