Document de poziție ESC: recomandări pentru implementarea farmacogenomicii în managementul bolilor cardiovasculare
Societatea Europeană de Cardiologie (ESC) a publicat un document de poziție ce reunește dovezile științifice acumulate până în prezent privind valoarea pe care farmacogenomica o poate aduce în managementul bolilor cardiovasculare (BCV). Farmacogenomica este un domeniu care studiază modul în care profilul genomic individual influențează răspunsul la medicamente.
Prin testarea genetică pot fi identificate variante care influențează modul în care pacienții metabolizează medicamentele, ceea ce permite alegerea tratamentului potrivit, reducerea costurilor și conduce la un prognostic superior pentru pacient față de o abordare „one-size-fits-all”. De asemenea, farmacogenomica oferă instrumentele necesare care pot revoluționa și producerea de molecule terapeutice pentru bolile cardiovasculare, dar și designul studiilor clinice.
Deși terapia ghidată de farmacogenomică este recunoscută de autoritățile de reglementare, nu există standarde la nivel european și internațional care să reunească datele acumulate pe baza progreselor științelor omice, astfel încât recomandările actuale sunt discordante. Farmacogenomica este o zonă explorată de categorii restrânse de profesioniști din domeniul sănătății. Pe măsură ce testele genetice adresate direct consumatorului devin din ce în ce mai des utilizate, se anticipează că multe date pot fi aduse în atenția medicilor chiar de către pacienți. O altă provocare ține de accesibilitatea la testele genetice. Pe lângă elementele care țin de implementarea testării farmacogenomice și complexitatea rezultatelor relevante clinic, există diferențe majore de resurse și expertiză la nivel european.
Este important ca societățile profesionale și sistemele de sănătate să ofere îndrumare medicilor în înțelegerea, interpretarea și implementarea farmacogenomicii în cardiologie.
Tranziția spre medicina personalizată în cardiologie și rolul farmacogenomicii
Costul secvențierii genomice a scăzut exponențial odată cu dezvoltarea tehnologiilor de secvențiere de generația a doua și a treia, de la aproximativ 2,7 miliarde de dolari în 2003 până la mai puțin de 1.000 dolari în 2019. Până în prezent, FDA a aprobat 298 de medicamente care prezintă referințe la markeri genetici. Majoritatea sunt indicate în oncologie și doar 15 dintre acestea în cardiologie.
Evoluția genomicii a oferit instrumente esențiale pentru implementarea medicinei personalizate în practică, un exemplu clar fiind schimbările din ultimele decenii în redefinirea prevenției, diagnosticului și tratamentului cancerului. Același tip de transformare se observă și în cazul cardiologiei.
În contextul farmacogenomicii, medicina personalizată poate fi definită drept capacitatea de a utiliza informația genomică pentru recomandarea agentului farmacologic potrivit pentru fiecare pacient, în doza potrivită la momentul potrivit și a minimiza riscul de reacții adverse.
Având în vedere aplicațiile pe care farmacogenomica le poate aduce în optimizarea managementului unor afecțiuni precum insuficiența cardiacă, bolile tromboembolice, aritmiile, dar și în revoluționarea unor domenii precum cardiologia intervențională, studiile clinice, activitatea instituțiilor de reglementare, experții ESC au reunit dovezile științifice care susțin acțiuni imediate cu relevanță clinică.
Cele mai importante recomandări din documentul de poziție ESC pot fi rezumate astfel:
- Metoprololul ar trebui evitat la persoanele cu profil de metabolism ultrarapid/slab, varianta CYP2D6, introducând o alternativă (ex. bisoprolul)
- Medicamentele care prelungesc intervalul QT ar trebui evitate la cei cu variante genetice asociate sindromului QT lung
- Înainte de inițierea tratamentului cu warfarină se recomandă genotiparea tuturor alelelor relevante (CYP2C9, VKORC1, CYP4F), indiferent de grupul etnic din care face parte pacientul
- Tratamentul cu clopidogrel ar trebui evitat la persoanele care au un profil de metabolizare slab/intermediar pe baza genotipării. Se recomandă genotiparea pacienților cu boli cardiovasculare la risc înalt înainte de administrarea acestui antiagregant, mai ales în prevenția trombozelor post implantare de stent
- Se recomandă evitarea simvastatinei în doză mare (80mg) și se indică o alternativă de tratament care poate scădea LDL-colesterolul la pacienții homozigoți pentru varianta SCLO1B1*5
- Farmacogenomica oferă instrumentele necesare pentru revoluționarea designului medicamentelor și studiilor clinice și a le face cost-eficiente

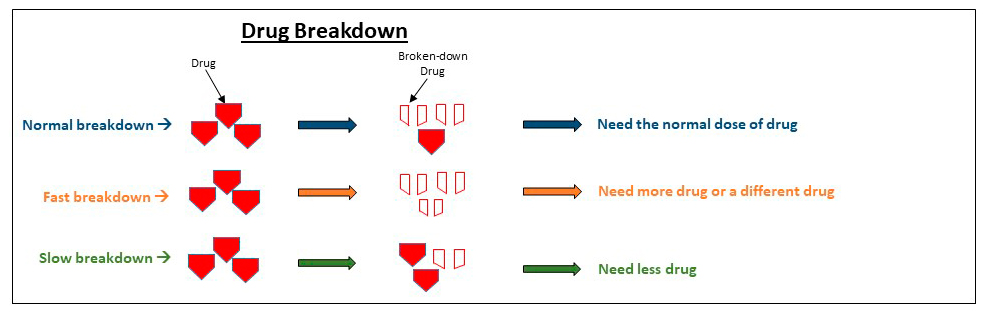
Răspunsul organismului uman la medicamente este determinat de două procese variabile, farmacocinetica și farmacodinamica. Farmacocinetica descrie modul în care fluctuează în timp concentrația unui medicament, timp în care medicamentul se stochează și se elimină din diferite compartimente ale organismului prin absorbție, distribuție, metabolism și excreție. Farmacodinamica se referă la efectele medicamentului asupra organismului (acțiunile medicamentelor la concentrații constante, acest termen cuprinzând interacțiunea cu receptorii, cu celulele țintă). Până acum, cele mai relevante abordări de farmacogenomică sunt concentrate pe metabolizarea medicamentelor.
Multe medicamente sunt metabolizate în ficat cu ajutorul enzimelor din familia citocromului P450 (CYP). Enzimele sunt codificate de diferite gene care sunt denumite în funcție de familia și subfamilia din care fac parte. De exemplu, în numele CYP2C9, 2-ul reprezintă familia, iar C – subfamilia. Pe lângă acestea, sunt descrise mai multe enzime, receptori, molecule transportoare cu rol în răspunsul organismului la agenții farmacologici.
Trei instrumente principale sunt utilizate în studiile de farmamacogenomică: studiile de asociere la nivelul întregului genom (GWAS), analiza genelor candidate și secvențierea de nouă generație (secvențierea masivă paralelă, de mare capacitate). Prin extinderea rolului secvențierii genomice, noi gene relevante vor fi identificate (ex. gene care determină eficacitatea unui medicament sau profilul de siguranță), iar aplicațiile clinice ale acestora vor transforma managementul clinic actual.
Anticoagulantele
Derivații cumarinici (warfarina, acenocumarolul) sunt folosiți pentru prevenția evenimentelor tromboembolice și funcționează prin inhibarea factorilor de coagulare dependenți de vitamina K. Există diferențe între țările europene cu privire la alegerea anticoagulantului oral din această clasă. Dozele de anticoagulant cumarnic necesare pentru un INR cuprins între 2-3 sunt variabile între indivizi. Datele din viața reală (RWD) arată că perioada medie în intervalul terapeutic TTR (time in therapeutic range, un indicator care măsoară calitatea tratamentului cu warfarină) este de 65%.
Având în vedere că doza stabilă de warfarină (WSD – warfarin stable dose) este caracterizată de o mare variabilitate și fereastra terapeutică este mică, riscul de reacții adverse este ridicat. Pentru warfarină, aproximativ 60% din variația WSD poate fi explicată prin variantele genelor VKORC1 și CYP2C9, urmate de CYMP4F2*3. Factorii clinici reprezintă sub 20%.
În acest context, se recomandă ca dozarea warfarinei la inițiere să fie ghidată de datele obținute prin genotipare. Pentru a optimiza o astfel de strategie, rezultatele testării genetice ar trebui să fie disponibile din prima zi a administrării terapiei, ceea ce presupune crearea premiselor pentru testarea accesibilă (point-of-care testing). Se recomandă genotiparea tuturor alelelor relevante (CYP2C9, VKORC1, CYP4F), indiferent de grupul etnic din care face parte pacientul.
Antiagregantele
Terapia antiplachetară cu aspirină și antagoniști ai receptorului P2Y12 este esențială în tratamentul bolii aterotrombotice, precum boala coronariană sau accidentul vascular cerebral. Clopidogrelul (un antagonist P2Y12) este un promedicament, care se transformă în forma activă prin 2 etape dependente de activitatea enzimei codificate de gena CYP2C19. O treime din pacienți au o activitate enzimatică redusă din cauza unor variante genetice cu pierdere de funcție (CYP2C19*2 și CYP2C19*3).
Având în vedere numărul mare de pacienți care primesc terapie antiplachetară, utilizarea farmacogenomicii pentru personalizarea tratamentului ar putea avea un impact semnificativ la nivel populațional. O metaanaliză a 6 studii randomizate care au evaluat tratamentul ghidat prin genotipare a demonstrat o reducere importantă a evenimentelor adverse clinice (reducerea evenimentelor adverse cardiovasculare și reducerea sângerărilor). Un studiu recent, TAILOR-PCI, care a inclus peste 5.000 de pacienți, sugerează superioritatea unei strategii bazată pe genotip, comparativ cu standardul actual. Utilizarea testării genetice în ghidarea terapiei antiplachetare post-PCI a determinat o reducere de peste 30% a evenimentelor cardiovasculare majore.
Realizarea profilului farmacogenomic pentru CYP2C19 este indicat în situațiile la risc înalt, cum ar fi pacienții cu sindrom coronarian acut care trebuie să urmeze o intervenție coronariană percutană (PCI) sau dacă se prezintă cu evenimente adverse recurente. Dacă pacienții au un profil lent sau intermediar de metabolizare a medicamentului, se recomandă o alternativă de tratament.
Statinele
Cea mai frecventă medicație hipolipemiantă este reprezentată de statine. Acestea sunt bine tolerate de cei mai mulți pacienți, însă există cazuri în care pot cauza hepatotoxicitate severă și sunt asociate cu dezvoltarea diabetului zaharat. Cel mai frecvent motiv pentru întreruperea tratamentului este reprezentat de apariția miopatiei, care se poate manifesta fie ca simple dureri musculare, fie ca afecțiuni amenințătoare de viață precum rabdomioliza. Distribuția statinelor în organism depinde de multe enzime și molecule transportoare.
Gena SLCO1B1 codifică un polipeptid 1B1 care transportă statinele la ficat și este esențial pentru eliminarea acestora. La purtătorii heterozigoți și mai ales la homozigoți pentru varianta SLCO1B1*5 cu pierdere de funcție s-a identificat o creștere a riscului de miopatie, prin creșterea concentrației plasmatice a tuturor statinelor, cu excepția fluvastatinei.
Rezumatul caracteristicilor produsului menționează că acolo unde este posibil, genotiparea pentru prezența mutației ar trebui luată în considerare ca parte a evaluării risc-beneficiu înainte de prescrierea a 80 mg de simvastatină, iar dozele înalte trebuie evitate pentru pacienții homozigoți pentru varianta SLCO1B1*5 care prezintă mutații cu pierdere de funcție.
Aritmiile
Principala afecțiune care predispune la aritmii și este asociată cu farmacoterapia este sindromul de QT lung, o tulburare de ritm cardiac care determină un risc crescut de moarte subită cardiacă. Un interval QT lung (LQT) este un factor de risc cunoscut pentru aritmiile ventriculare (torsada vârfurilor și moarte subită cardiacă). Cazurile dobândite de interval QT lung pot fi reprezentate de boli cardiace sau cel mai frecvent sunt induse medicamentos. Susceptibilitatea la o prelungire a intervalului QT poate fi determinată genetic. Rudele de gradul întâi ale pacienților cu sindrom QT lung congenital au un risc mai mare de QT lung indus medicamentos.
Gena NOS1AP, localizată pe cromozomul 1, este puternic asociată cu durata intervalului QT, conform datelor din studii GWAS. Medicamentele care prelungesc intervalul QT trebuie evitate la persoanele cu variante genetice asociate cu risc de LQT. Nu se recomandă genotiparea prospectivă în absența unui fenotip sugestiv sau istoricului familial.
Tratamentul pentru hipertensiunea arterială
În Europa, HTA primară este o cauză principală de morbiditate și mortalitate în ciuda tratamentelor disponibile și a recomandărilor privind stilul de viață. Există peste 1000 de locusuri genetice asociate cu reglarea tensiunii arteriale și se înțelege tot mai bine componenta poligenică a HTA datorită GWAS.
Studiul GenHAT a fost cel mai mare studiu randomizat care a explorat utilitatea testelor genetice în predicția răspunsului la terapia antihipertensivă. Cu toate acestea, nu s-a demonstrat încă un beneficiu clinic semnificativ pentru a justifica alegerea tratamentului antihipertensiv în funcție de genotip. Documentul de poziție precizează că momentan nu există suficiente dovezi pentru a susține ghidarea tratamentului în funcție de componenta genomică.
Impactul asupra studiilor clinice
În ciuda poverii în creștere a BCV, dezvoltarea de medicamente s-a lovit de multiple provocări. Comparativ cu alte arii terapeutice, dezvoltarea de medicamente pentru bolile cardiovasculare este mai costisitoare. Este necesară o reformă a studiilor clinice, iar farmacogenomica oferă instrumentele necesare pentru revoluționarea designului medicamentelor și studiilor clinice și pentru a le face cost-eficiente.
Studiile clinice randomizate necesită un număr mare de pacienți pentru a demonstra un efect clinic. Interesul lumii științifice este orientat asupra selectării pacienților care ar avea cele mai mari beneficii în urma unui anumit tratament și astfel să fie redus necesarul unei cohorte foarte mari. Designurile prospective ar trebui optimizate și recunoscute limitările analizelor post-hoc de subgrup. De asemenea, datele din viața reală pot aduce avantaje majore.
Citește și
- #ACC20. Utilizarea testării genetice în ghidarea terapiei antiplachetare post-PCI, asociată cu o reducere de peste 30% a evenimentelor cardiovasculare majore
- #ESCCongress. Alegerea terapiei antitrombotice în funcție de profilul genetic, o strategie optimă pentru pacienții care au suferit o intervenție coronariană percutană

