Facilitarea accesului la studii clinice la nivel european: Clinical Trial and Information System va fi lansat începutul anului 2022
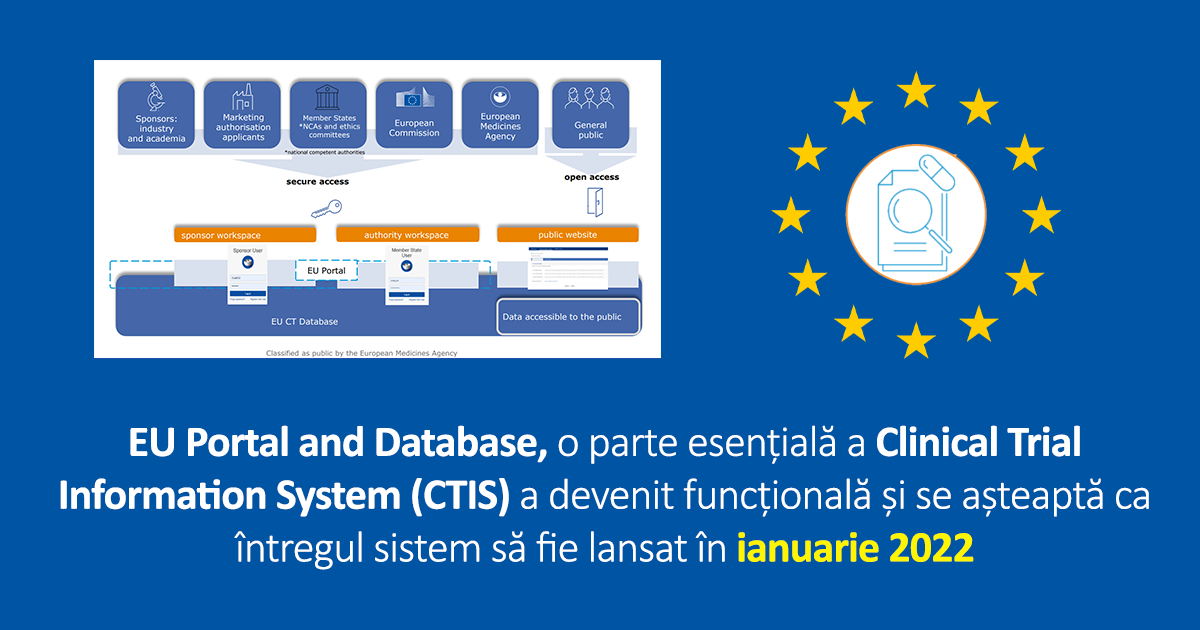
Consiliul de administrație al Agenției Europene a Medicamentului (EMA) a confirmat faptul că Portalul și Baza de Date Europeană pentru Studii Clinice (EU Portal and Database) sunt pe deplin funcționale și vor fi inaugurate pe 31 ianuarie 2022. Acestea sunt facilitate prin Sistemului Informatic pentru Studiile Clinice (CTIS), care reprezintă un pas important în aplicarea obiectivelor Reglementării pentru Studii Clinice (Clinical Trial Regulation). Scopul este crearea unui mediu favorabil pentru derularea studiilor clinice la nivel UE, cu cele mai înalte standarde de siguranță pentru participanți și creșterea transparenței.
Agenția Europeană a Medicamentului a setat CTIS în colaborare cu Statele Membre și Comisia Europeană. Odată implementat, CTIS va fi singura cale de acces pentru aplicațiile de studii clinice în UE. Sponsorii studiilor clinice vor putea aplica pentru un studiu în toate țările Regiunii Economice Europene, în loc să aplice separat pentru fiecare țară. Sistemul va facilita recrutarea participanților la studii clinice și va permite sponsorilor, cercetătorilor și autorităților naționale din diferite State Membre să colaboreze.
„Implementarea CTIS va crește eficiența proceselor de înregistrare, derulare și monitorizare a studiilor clinice la nivel UE, mai ales acelea care se desfășoară în mai multe State Membre, ceea ce asigură transparența față de public. Acesta reprezintă unul dintre cele mai ambițioase proiecte IT dezvoltate de EMA și așteptăm evenimentul de deschidere în 2022” – Christa Wirthumer-Hoche, EMA Management Board
Consiliul EMA a confirmat că a verificat dacă CTIS îndeplinește cerințele convenite în cursul unei reuniuni extraordinare desfășurate la 21 aprilie, în urma unui audit independent al acestui nou sistem IT. În continuare, Consiliul va informa Comisia Europeană cu privire la acest rezultat. După ce s-a asigurat că au fost îndeplinite condițiile stabilite de regulamentul privind trialurile clinice, Comisia Europeană va publica un aviz în Jurnalul Oficial al Uniunii Europene și la șase luni de la această publicare, regulamentul privind trialurile clinice va începe să se aplice și CTIS va fi disponibil la nivel UE. Dorința Consiliului de administrație, a EMA și a Comisiei Europene este ca sistemul să intre în vigoare la 31 ianuarie 2022, ceea ce ar însemna că notificarea Comisiei în Jurnalul Oficial va fi publicată la 31 iulie 2021.
Citește și:
- Raportul „Studii Clinice – investiții străine în România”: doar 10 studii clinice la 1 milion de locuitori se află în derulare începând cu mai 2019
- Simpozionul Anual de Studii Clinice 2020: impactul pandemiei COVID-19 asupra cercetării clinice și oportunități pentru viitor

