Terapia celulară CAR-T Kymriah demonstrează beneficii clinice la adulții cu limfom folicular
Novartis a anunțat rezultate preliminare pozitive din studiul ELARA, în cadrul căruia a fost evaluată eficiența terapiei CAR-T, tisagenlecleucel (Kymriah), la pacienți adulți cu limfom folicular (LF) recidivat sau refractar (r/r). La analiza interimară prestabilită, obiectivul primar care vizează rata de răspuns complet a fost îndeplinit. Beneficiile clinice demonstrate de terapie în studiu vor fi prezentate oficial în cadrul unei conferințe medicale în perioada următoare și vor fi incluse în aplicațiile de aprobare depuse autorităților din Statele Unite ale Americii (posibil în 2021) și din Uniunea Europeană.
Pe baza rezultatelor preliminare ale ELARA, Administrația Alimentelor și Medicamentelor din SUA (FDA) a acordat titlul de Regenerative Medicine Advanced Therapy (RMAT – terapie avansată a medicinei regenerative). Această desemnare are rolul de a accelera procesul de evaluare și aprobare a terapiei pentru această populație de pacienți cu opțiuni terapeutice insuficiente în acest moment.
Anunțul eficienței clinice a Kymriah în LF a coincis cu atingerea reperului de producere a 3.000 de loturi de celule CAR-T la nivel global și cu aprobarea a două centre adiționale de producție comercială în Europa.
„Suntem încântați să anunțăm că terapia celulară Kymriah demonstrează rezultate semnificative și ar putea oferi un potențial tratament definitiv pentru pacienții cu limfom folicular recidivat sau rezistent. Aceste rezultate susțin eforturile noastre de a reimagina tratamentul acestui cancer incurabil și de a susține această populație insuficient deservită, care este împovărată de ani de tratamente mutiple”– Dr. John Tsai, șef al departamentului de dezvoltare al medicamentelor și ofițer șef medical Novartis.
Studiul ELARA
ELARA este un studiu deschis, de fază II, multicentric, care evaluează siguranța și eficiența tisagenlecleucel, având ca obiectiv primar rata de răspuns complet. Acesta a înrolat adulți cu LF r/r din 30 de centre din 12 țări. Pentru a putea fi incluși în studiu, pacienții trebuie să aibă vârsta peste 18 ani, să aibă LF grad 1, 2, sau 3A, care îndeplinește, în plus, una dintre următoarele condiții:
- este refractar la a doua linie de tratament, sau tratamente ulterioare acesteia;
- a recidivat la mai puțin de 6 luni de la terminarea tratamentului de linie a doua sau ulterior;
- a recidivat în timpul sau în primele 6 luni de la finalizarea terapiei de întreținere anti-CD20;
- a recidivat după transplant autolog de celule stem hematopoietice.
Pacienții cu afectare a sistemului nervos central sau cei care au urmat terapii anti-CD19, terapii genice, sau transplant alogenic de celule stem hematopoietice nu au fost eligibili.
Despre Kymriah (tisagenlecleucel)
Kymriah este prima terapie CAR-T aprobată FDA și prima terapie CAR-T aprobată pentru două indicații:
- tratamentul leucemiei limfoblastice acute r/r la pacienți pediatrici și cei sub 25 de ani;
- tratamentul limfomului difuz cu celule B mari, r/r, la adulți.
Datele din practica medicală au confirmat beneficiile tisagenlecleucel în cele două indicații. În plus, s-a demonstrat că tratamentul cu Kymriah este eficient pentru o categorie mai largă de pacienți, inclusiv pacienții vârstnici și cei care au primit anterior mai multe linii terapeutice, iar efectele adverse precum sindromul de eliberare de citokine și neurotoxicitatea au fost mai puțin frecvente în studiile post-aprobare, față de studiile clinice.
Tisagenlecleucel este rezultatul unei alianțe strategice între industrie și mediul academic (Novartis și Facultatea de Medicină Perelman a Universității din Pennsylvania), prima de acest fel în cercetarea și dezvoltarea CAR-T.
Kymriah este aprobat pentru cel puțin o indicație în peste 25 de țări, având peste 250 de centre de tratament certificate. În prezent, există șapte centre de producție CAR-T, pe patru continente, însă capacitatea de producție este în continuă dezvoltare. În Europa există două centre pentru producția comercială a Kymriah, în Stein, Elveția și Les Ulis, Franța.
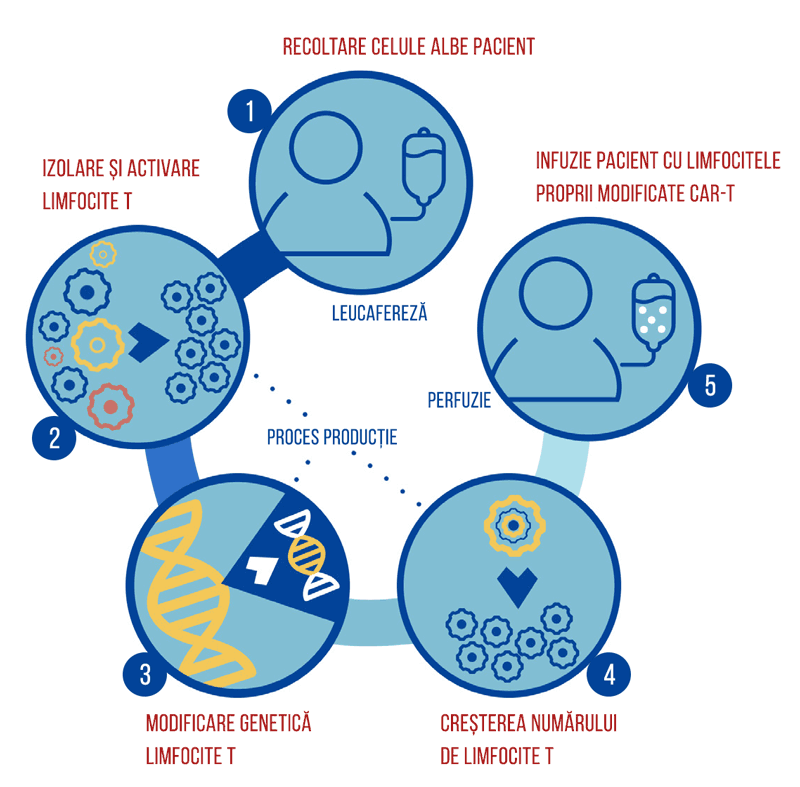
Tisagenlecleucel poate cauza reacții adverse severe sau amenințătoare de viață, precum sindromul de eliberare de citokine sau toxicitatea neurologică. De aceea, tratamentul este oferit doar în cadrul unui program restrictiv de evaluare și scădere al riscului (Kymriah REMS, Risk Evaluation and Mitigation Strategy).
Sindromul de eliberare de citokine se poate manifesta prin dificultăți în respirație, febră, frison, greață, vărsături și diaree, dureri musculare și articulare severe, hipotensiune, sau amețeli. Toxicitatea neurologică poate produce alterarea sau scăderea conștienței, dureri de cap, delir, confuzie, agitație, anxietate, convulsii, dificultăți în producerea și înțelegerea limbajului, sau pierderea echilibrului.
Alte reacții adverse posibile includ reacții alergice severe, inclusiv anafilaxie. Toate reacțiile adverse trebuie raportate medicului curant.
Despre limfomul folicular
Limfomul folicular este a doua cea mai comună formă de limfom non-Hodgkin (HNL), reprezentând aproximativ 22% din totalul de cazuri LNH. Chiar dacă există tratamente noi care au crescut supraviețuirea, LF este în continuare descris ca un cancer incurabil, cu evoluție recurentă și remisivă. Numărul median de linii de tratament urmate de pacienții cu LF este de 5, dar există cazuri cu până la 12 linii de tratament. Deoarece eficiența liniilor de tratament scade rapid, iar unii pacienți devin rapid rezistenți la tratament, LF este în continuare o arie în care sunt necesare noi tratamente.
Citește și:
- #ASH19. Datele din practica medicală confirmă eficacitatea și siguranța terapiei celulare Kymriah, pentru pacienții cu limfom difuz cu celulă mare B și leucemie acută limfoblastică
- BREAKING NEWS. Kymriah, prima terapie celulară CAR-T aprobată în UE. Începe o nouă eră în tratamentul cancerului
- FDA: terapia CAR-T Kymriah primește a doua aprobare, pentru tratamentul limfomului cu celule B mari recurent sau refractar

