Premiul Nobel pentru Medicină sau Fiziologie 2025: descoperirea mecanismelor care împiedică sistemul imunitar să atace propriul organism
Mary E. Brunkow, Fred Ramsdell și Shimon Sakaguchi sunt laureații Premiului Nobel pentru Fiziologie sau Medicină 2025, premiați pentru descoperirile fundamentale privind toleranța imună periferică, un mecanism esențial care previne atacarea propriilor țesuturi de către sistemul imunitar. Cercetătorii au identificat celulele T reglatoare, considerate „gardienii” sistemului imunitar, esențiale în prevenirea bolilor autoimune și în menținerea echilibrului imun. Descoperirile lor au deschis noi perspective pentru dezvoltarea terapiilor inovatoare în cancer, boli autoimune sau în transplantul de organe.

Despre laureați
Shimon Sakaguchi s-a născut în 1951 în Japonia; a obținut diploma de medic în 1976 și titlul de doctor în 1983 la Kyoto University. În prezent este profesor la Immunology Frontier Research Center din cadrul Universității Osaka. Mary E. Brunkow s-a născut în 1961 în Statele Unite. A obținut titlul de doctor la Universitatea Princeton și activează în prezent ca Senior Program Manager la Institute for Systems Biology, Seattle. Fred Ramsdell s-a născut în 1960 în Statele Unite. A obținut titlul de doctor la Universitatea California, Los Angeles (UCLA) în anul 1987 și lucrează în prezent ca și consilier științific la compania Sonoma Biotherapeutics, San Francisco.
Citește și: Premiul Nobel pentru Medicină sau Fiziologie 2025: descoperirea gardienilor imunității – celulele T reglatoare
Contextul științific
Sistemul imunitar reprezintă linia principală de apărare a organismului împotriva bacteriilor, virusurilor și altor agenți patogeni. În fiecare zi, acesta detectează mii de „invadatori” și trebuie să facă diferența între celulele proprii și cele străine. Unele microorganisme au dezvoltat mecanisme de camuflaj, imitând celulele umane, ceea ce poate determina sistemul imunitar să reacționeze greșit și să atace propriile țesuturi. Astfel apar bolile autoimune, precum lupus, artrită reumatoidă, scleroză multiplă sau diabet de tip 1.
Celulele T joacă un rol central în apărarea organismului. Helper T (CD4⁺) detectează invadatorii și alertează alte celule imune, iar Killer T (CD8⁺) distrug celulele infectate sau tumorale. Pe suprafața lor se află receptori TCR, care acționează ca senzori unici, permițând recunoașterea a peste 10¹⁵ agenți patogeni diferiți și protejând organismul fără a ataca propriile țesuturi.
Celulele T reglatoare (sau Tregs) reprezintă o subpopulație specializată de limfocite T CD4+ care joacă un rol crucial în menținerea echilibrului sistemului imunitar și prevenirea reacțiilor autoimune. Acestea supraveghează activitatea altor celule imune pentru a împiedica atacarea propriilor țesuturi sau reacțiile exagerate la stimuli inofensivi, cum ar fi antigenii alimentari sau bacteriile benefice din intestin. Caracteristica definitorie a acestora este expresia factorului de transcripție Foxp3, esențial pentru stabilitatea și funcția lor.
Funcția celulelor T reglatoare se realizează prin mai multe mecanisme complexe, care acționează împreună pentru a menține echilibrul sistemului imunitar:
- Producerea de citokine inhibitoare, precum IL-10, TGF-β și IL-35, care reduc activitatea celulelor T efector și limitează reacțiile inflamatorii.
- Blocarea semnalelor de activare prin eliminarea sau inhibarea moleculelor stimulatoare de pe suprafața celulelor prezentatoare de antigen (APC).
- Sechestrarea interleukinei-2 (IL-2) – Tregs capturează această citokină esențială pentru creșterea și activarea altor celule T, reducându-i astfel disponibilitatea și împiedicând proliferarea necontrolată a sistemului imun.
- Modificarea mediului metabolic local, creând condiții care limitează activarea excesivă a celulelor T efector și favorizează un răspuns imun controlat și echilibrat.
Mai mult, Tregs prezintă o plasticitate adaptativă, ceea ce înseamnă modifica programele transcripționale și comportamentul lor în funcție de mediul tisular. Ele sunt prezente atât în organele limfoide secundare, cât și în țesuturi non-limfoide, precum pielea, intestinul, ficatul sau micromediul tumoral. Prin aceste funcții integrate, celulele T reglatoare asigură toleranța imună periferică și protejează organismul împotriva bolilor autoimune, menținând în același timp capacitatea de a răspunde eficient la infecții și alte amenințări.
Evoluția descoperirilor și impactul lor
Încă din perioada anilor 1970, oamenii de știință bănuiau că există un tip de celule T care ar putea controla răspunsul imun și preveni bolile autoimune. Aceste celule erau denumite T supresoare, însă experimentele timpurii nu au putut confirma existența lor, iar ipoteza a fost abandonată temporar.
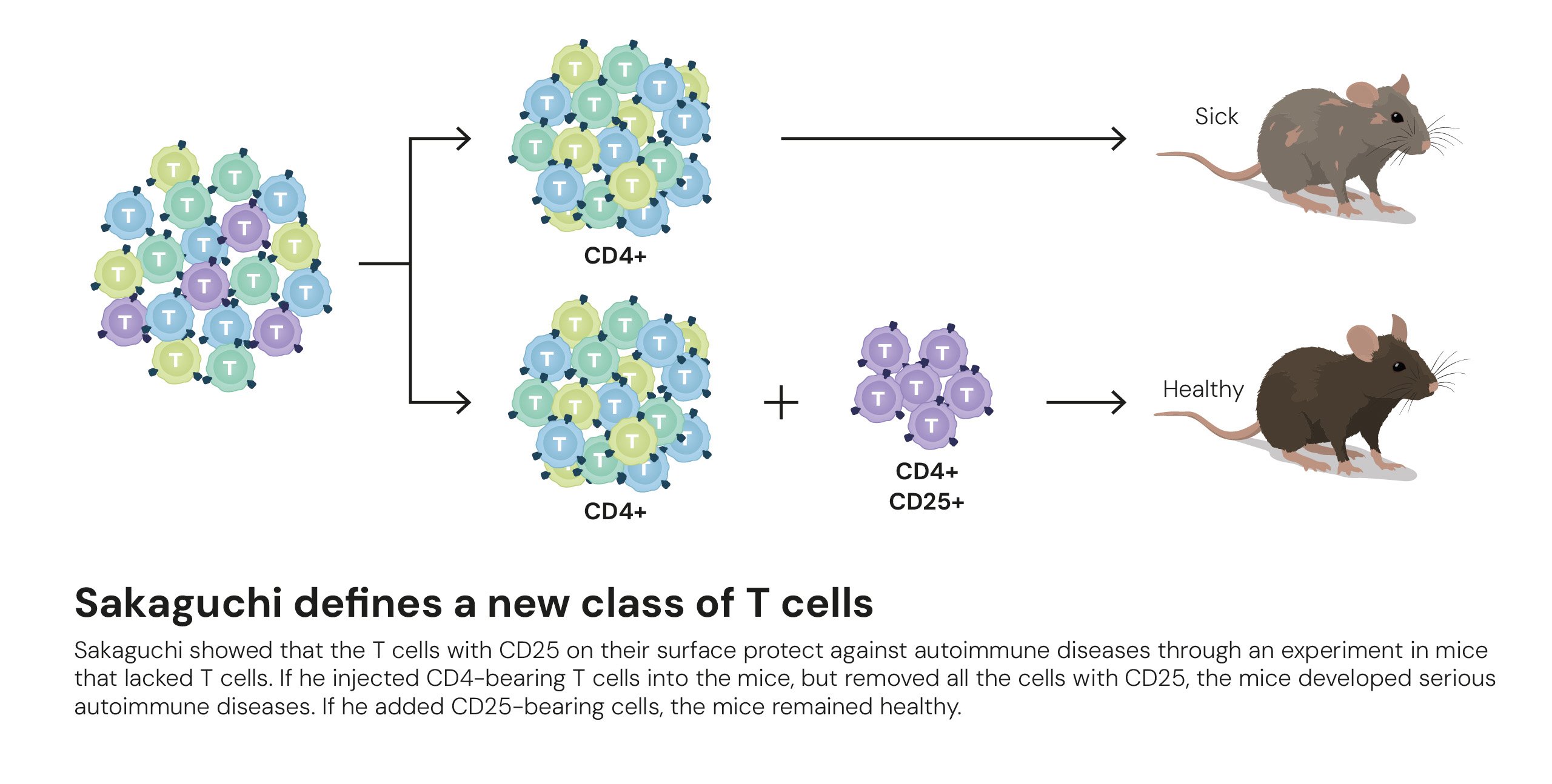
În 1995, Shimon Sakaguchi a reluat studiile și s-a concentrat pe timus, organul unde celulele T se maturizează și învață să recunoască țesuturile proprii. El a descoperit o subpopulație de celule T helper care exprimau proteinele CD4 și CD25 și care erau esențiale pentru prevenirea atacului sistemului imunitar asupra organismului. Când aceste celule au fost eliminate la șoareci, animalele au dezvoltat inflamații severe în mai multe organe, ceea ce a demonstrat că aceste celule acționează ca protectori ai organismului. Această descoperire a condus la identificarea celulelor T reglatoare.
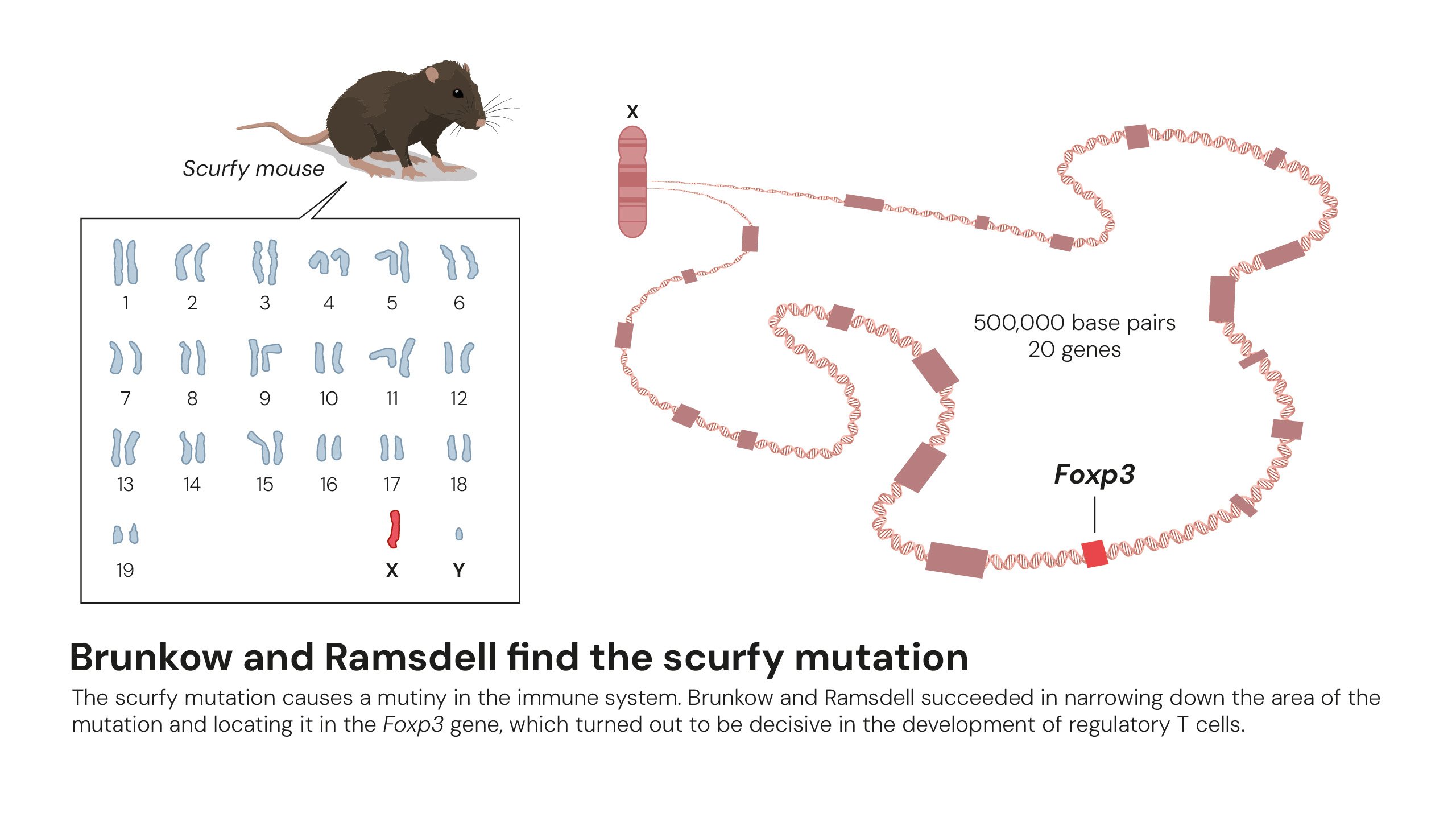
Câțiva ani mai târziu, Mary Brunkow și Fred Ramsdell au studiat o subpopulație de șoareci numită „scurfy”, extrem de vulnerabilă la boli autoimune. Ei au descoperit că acești șoareci aveau o mutație a genei FOXP3. Mai târziu s-a demonstrat că mutațiile corespunzătoare la oameni cauzează sindromul IPEX, o boală autoimună gravă.
În continuare, Sakaguchi a arătat că FOXP3 controlează dezvoltarea celulelor T reglatoare identificate anterior, oferind o bază moleculară clară pentru mecanismul toleranței periferice și explicând modul în care organismul previne atacul propriilor țesuturi. Această corelare a descoperirilor a completat imaginea și a demonstrat cum funcționează „gardienii” sistemului imunitar la nivel molecular.
Astfel, descoperirile lui Brunkow, Ramsdell și Sakaguchi au redefinit modul în care înțelegem sistemul imunitar. Ele arată că toleranța imună nu depinde doar de eliminarea celulelor T dăunătoare în timus, ci și de existența unor celule speciale care supraveghează sistemul imunitar și protejează organismul de reacții autoimune. Această înțelegere a permis dezvoltarea unor strategii terapeutice inovatoare pentru boli autoimune ori terapii oncologice.
Aplicații medicale și cercetări în curs
Descoperirile lor au deschis numeroase perspective terapeutice:
- Cancer: Celulele T reglatoare sunt adesea prezente în tumorile maligne și diminuează răspunsul imun împotriva acestora. Cercetătorii explorează modul în care le-ar putea inhiba pentru a crește eficiența terapiilor anti-tumorale.
- Transplanturi: Celulele T reglatoare pot fi prelevate de la pacient, multiplicate în laborator și reinfuzate pentru a crește toleranța organismului la organul transplantat. O abordare avansată implică optimizarea acestor celule cu un receptor chimic pentru antigen (CAR). Aceste regulatory CAR-T cells pot recunoaște și lega celulele unui organ transplantat, suprimând astfel răspunsul imun specific și reducând riscul de respingere. Studiile clinice inițiale efectuate de compania Sonoma Biotherapeutics la pacienții cu artrită reumatoidă au arătat rezultate preliminare promițătoare, demonstrând fezabilitatea și potențialul acestei terapii.
- Boli autoimune: Corectarea mutațiilor FOXP3 poate restabili funcția celulelor T reglatoare, reducând inflamația și prevenind atacurile autoimune, cum ar fi artrita reumatoidă sau diabetul de tip 1. În paralel, cercetătorii explorează utilizarea celulelor T reglatoare cultivate în laborator sau modificate genetic (inclusiv CAR-T) pentru a controla răspunsurile imune excesive și a trata boli autoimune severe.
„Cred că acest lucru va încuraja imunologii și medicii să utilizeze celulele T reglatoare pentru a trata diverse boli imunologice” – a spus Sakaguchi comitetului într-un apel telefonic.
Perspective de viitor
Manipularea celulelor T reglatoare poate oferi, așadar, metode de control al răspunsurilor imune excesive, prevenind bolile autoimune și îmbunătățind succesul transplanturilor de organe. În oncologie, ele pot fi fie inhibate pentru a stimula răspunsul imun împotriva tumorilor, fie folosite pentru a reduce inflamația asociată tratamentelor.
Munca celor trei cercetători reprezintă un pas esențial în medicina modernă, demonstrând cum cercetarea fundamentală asupra sistemului imunitar poate avea efecte directe asupra tratamentului și prevenirii bolilor și deschizând calea către terapii personalizate și intervenții clinice inovatoare.
Citește și:
- Premiul Nobel pentru Medicină sau Fiziologie 2024: rolul microARN în reglarea activității genelor
- Premiul Nobel pentru Medicină sau Fiziologie 2023: Katalin Karikó și Drew Weissman – vaccinurile ARNm împotriva COVID-19
- Premiul Nobel pentru Fiziologie sau Medicină 2020: descoperirea virusului hepatitic C

