STUDIU. De ce nu mai răspund la tratament 40% dintre pacienții cu cancer pulmonar?
Imunoterapiile s-au impus în ultimii ani, în unele tipuri de cancer, drept standard de tratament, atât datorită eficacității crescute cât și unui profil bun de siguranță. Cu toate acestea, în prezent, există categorii selecționate de pacienți pentru care acestea nu se potrivesc. Limitările sunt cauzate de mecanismele complexe prin care celulele canceroase rămân nedetectate de sistemul imun.
Unul dintre mecanismele prin care tumorile nu sunt recunoscute și distruse de celulele imune este pierderea heterozigoției (LOH – Loss of Heterozygosity) la nivelul genelor care codifică antigenul leucocitar uman – HLA. Această modificare genetică a fost identificată la 40% dintre pacienții cu carcinom pulmonar non-microcelular (NSCLC), cu ajutorul sistemul bioinformatic numit LOHHLA (loss of heterozygosity in human leukocyte antigen). Cazurile examinate fac parte din proiectului TRACERx, primul studiu ce a urmărit evoluția cancerului în detaliu și care reprezintă cea mai mare investiție din Marea Britanie pentru cercetarea cancerului pulmonar.
Datele au fost prezentate luna trecută, în cadrul unei conferinței internaționale pentru tratamentul cancerului organizată de cele mai mari instuții de cercetare în oncologie din SUA și Europa: AACR (American Association for Cancer Research), NCI (National Cancer Institute), EORTC (European Organisation for Research and Treatment of Cancer).
„Am observat că pierderea heterozigoției la nivelul HLA este un eveniment foarte frecvent, care are loc tardiv în cursul evoluției tumorale. Aceste date ne ajută să înțelegem de ce tumora nu e recunoscută de sistemul imun și să putem dezvolta noi imunoterapii care să țintească neoantigenele” – Rachel Rosenthal, doctorand la University College London
Pricipalele informații din studiu:
- Pierderea heterozigoției la nivelul genelor HLA se poate detecta la 40% din cazurile de cancer pulmonar non-microcelular încă din primele stadii
- Tehnica propusă în acest studiu a reușit detectarea reapariției cancerului mai devreme cu un an față de metodele actuale
- Sistemul LOHHLA permite estimarea dispariției alelelor HLA din datele obținute prin secvențiere genetică
- Tumorile care exprimă HLA LOH sunt asociate cu un număr mare de mutații genetice ne-sinonime (care modifică expresia de proteine codificată de gena respectivă)
- Prezența HLA LOH s-a corelat cu o cantitate crescută de neoantigene exprimate la nivel tumoral și cu niveluri ridicate de PD-L1
- Pacienții cu o instabilitate cromozomială crescută la nivel tumoral au de 4 ori mai multe șanse de recădere sau de deces la doi ani
Ce este antigenul leucocitar uman – HLA?
Sistemul HLA (antigenul leucocitar uman) desemnează un grup de molecule aflate pe suprafața majorității celulelor din organism. Complexul HLA ajută sistemul imun să facă diferența între proteinele proprii organismului și proteine de altă origine, de exemplu care aparțin bacteriilor sau virusurilor. Genele care codifică antigenele HLA se află la nivelul cromozomului 6 și reprezintă varianta umană a unei familii de gene întâlnită la mai multe specii, numită MHC (complex major de histocompatibilitate).
Proteinele MHC de clasă I se găsesc la nivelul membranei tuturor celulelor din organism pe când moleculele MHC de clasă II se află doar pe suprafața unor celule imune – macrofage și limfocite. Fiecare genă a complexului MHC are un număr foarte mare de alele (forme diferite ale genei care produc proteine variate) și este foarte puțin probabil ca două persoane să aiba același set de molecule MHC. Diversitatea proteinelor MHC are efect de protecție, fiind mult mai dificil pentru ca agenții străini să evite sistemul imun.
Sistemul imun monitorizează atât tipul antigenelor (peptide self, care provin din proteine proprii organismului, cât și peptide străine, produse de diverși agenți patogeni) prezentate de către MHC cât și numărul lor. Celulele imune recunosc și distrug, astfel, și celulele canceroase care exprimă de obicei cantități mari de antigene-self.
Înțelegerea rolului neoantigenelor în carcinogeneză este esențială pentru că acestea reprezintă o țintă care ar putea crește răspunsul la imunoterapii pentru cât mai mulți pacienți. Neoantigenele sunt fragmente de proteine ce rezultă din numărul mare de mutații identificat în ADN-ul celulelor canceroase.
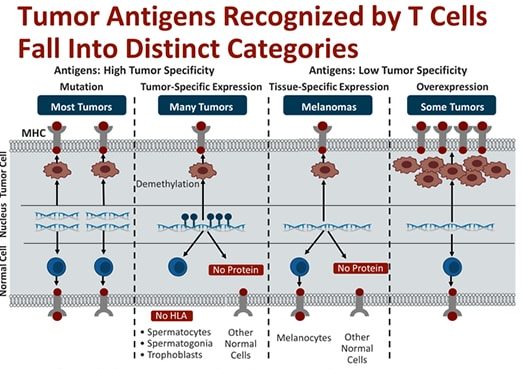
Pierderea heterozigoției și instrumentul LOHHLA ?
Prezența moleculelor HLA de clasă I pe suprafața celulelor canceroase este esențială pentru recunoașterea și distrugerea realizată de limfocitele T CD8+. Majoritatea celulelor din organismul uman au două seturi de gene care codifică molecule de clasă I HLA, un set transmis pe linie maternă și unul pe linie paternă. Uneori apar modficări genetice ce termină pierderea unui set de gene. Acest fenomen e cunoscut sub numele de LOH (loss of heterozygosity – pierderea heterozigoției) și reprezintă unul dintre mecanismele prin care procesul neoplazic scapă de sub detecția sistemului imun.
Oamenii de știință de la mai multe centre universitare din UK au dezvoltat un instrument numit LOHHLA (loss of heterozygosity in human leukocyte antigen) pentru a analiza datele obținute prin secvențierea genetică a probelor de la nivel tumoral și a determina numărul de modificări la nivelul alelelor HLA în dinamică . Din cauza variabilității genelor HLA, foarte puține secvențe se potrivesc genomului uman de referință. Asta înseamnă că nu este posibil să se identifice pozițiile heterozigote, care sunt necesare pentru analiza LOH. Sistemul LOHHLA rezolvă acest inconvenient, analizând secvențe care țin de linia germinală pentru a detecta numărul de copii specifice haplotipului. Printr-un algorim complex reușește să determine cu precizie numărul de copii de la nivelul locusului HLA care suferă modificări în evoluția cancerului.
Studiul TRACERx
TRACERx (tracking cancer evolution through therapy), este un studiu inițiat în 2014 în Marea Britanie prin care s-a urmărit progresia cancerului pulmonar non-microcelular. Proiectul s-a ridicat la un cost de 14 milioane de lire sterline și este cea mai mare investiție pentru studierea cancerului pulmonar realizată de Cancer Research din UK.
Datele obținute permit, în prezent, prezicerea cu o rată de succes de 92% a recurenței bolii prin analiza ADN-ului pacientului. 100 de pacienți cu carcinom pulmonar non-microcelular (NSCLC) au fost incluși în studiu. În prezent sunt peste 500 de cazuri.
La includerea în studiu, s-a realizat secvențierea genetică de la nivelul tumorii pacientului pentru a se crea un „șablon” al genomului cancerului pentru fiecare individ. Bolnavii erau testați apoi, regulat și rezultatele erau comparate cu datele inițiale. Orice modificare la nivelul ADN-ului urma să fie examinată pentru a identifica o corelație cu o posibilă recădere.
Modificările de tip HLA LOH au fost detectate la 40% dintre pacienți. Prin TRACERX s-au detectat semne precoce de recurență în 13 din 14 cazuri. Instabilitatea cromozomială s-a dovedit a fi principalul determinant al diversității genetice care se regăsește la nivel tumoral.
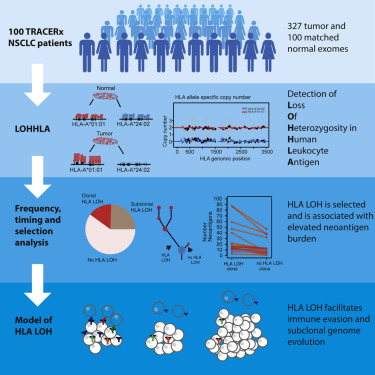
Rezultatele obținute din TRACERx corespund cu date din alte studii clinice. De exemplu, cu o analiză a 692 de pacienți cu NSCLC inclusă în The Cancer Genome Atlas (TCGA). TCGA este un proiect înființat în 2005 care își propune catalogarea mutațiilor genetice corespunzătoare cancerului cu ajutorul secvențierii genetice și sistemelor bioinformaționale.
De asemenea, rezultele studiul TRACERx sunt similare cu cele obținute dintr-o analiză a 37 de probe de la nivelul unor metastaze cerebrale ale NSCLC. Pentru 53% dintre cazurile studiate în această analiză s-a observat apariția a cel puțin unei modificări genetice la nivelul metastazelor cerebrale care nu a fost prezentă în tumora primară.
Prezența HLA LOH a fost asociată cu o producție crescută de neoantigene, mutații la nivelul ADN induse de familia de enzime APOBEC, expresia crescută a PD-L1, toate aceste mecanisme facilitând într-un fel sau altul proliferarea tumorală.
Frecvența HLA LOH, nivelul lor crescut în zonele cu metastaze și observarea lor ca evenimente paralele sugerează că HLA LOH reprezintă un mecanism care rămâne nedetectat de sistemul imun și apare tardiv în evoluția tumorală. Principala limitare a studiului este că în prezent au fost examinate doar cancere de tip NSCLC.
Ce aplicații are instrumentul LOHHLA?
Tehnica propusă în acest studiu a reușit detectarea reapariției cancerului mai devreme cu un an față de metodele actuale.
Studiul ar putea avea implicații în dezvoltarea de vaccinuri sau metode terapeutice care să implice modularea limfocitelor T, având ca țintă neoantigenele. HLA LOH ar putea indica ce set de neoantigene sunt mai susceptibile să determine un răspuns din partea limfocitelor T.
Rezultate permit dezvoltarea unei noi metode de monitorizare a pacienților după tratamentul chirurgical și determină apariția de noi terapii care să țintească exact partea din tumoră responsabilă de rezistența la tratament. Se pot chiar identifica pacienții care beneficiază de tratament înainte de apariția semnelor clinice.
„Rezultatele din TRACERx ne oferă o foarte bună imagine a modului în care cancerul evoluează de-a lungul timpului. Această analiză detaliată ne poate ajuta să găsim o abordare personalizată a tratamentului acestei boli. Ne dorim să recrutăm peste 840 de pacienți în TRACERx, pornind de la niște date inițiale încurajatoare” – Yenting Ngai, investigator.
Subiecte similare:
- STUDIU. Câte mutații genetice sunt necesare pentru apariția cancerului?
- Terapiile CAR T: Programarea propriilor celule T pentru a lupta împotriva cancerului – cum funcționează și care sunt provocările
- #ESMO17. Prima biopsie lichidă care poate selecta pacienții ce răspund cel mai bine la imunoterapie
- #ESMO17: Secvențierea genomului poate ajuta la identificarea tratamentelor potrivite pentru unele cancere rare

