Prima terapie genică pentru pacienții cu adrenoleucodistrofie cerebrală, aprobată în Uniunea Europeană
Update 21 iulie 2021: Terapia a primit aprobarea Comisiei Europene.
Comitetul pentru Produse Medicale de Uz Uman (CHMP) din cadrul Agenției Europene a Medicamentului (EMA) a emis recomandarea pentru autorizația de punere pe piață a terapiei genice Skysona (elivaldogene autotemcel) pentru tratamentul pacienților cu vârste de sub 18 ani, cu adrenoleucodistrofie cerebrală, o formă severă a unei boli ereditare neurodegenerative progresive.

Skysona reprezintă prima terapie genică pentru pacienții cu această patologie. Printr-o singură injecție, este livrată o copie funcțională a genei ABCD1, care oprește evoluția bolii prin producția susținută a proteinei ALD, deficitară în cazul acestor pacienți.
O analiză efectuată la 24 de luni de la administrarea terapiei genice a arătat că pentru 90% dintre pacienți, terapia genică a condus la păstrarea funcțiilor motorii și abilităților de comunicare, îmbunătățind totodată și supraviețuirea.
Despre adrenoleucodistrofie
Adrenoleucodistrofia (ALD) este o boală metabolică genetică rară, care afectează 1 din 21.000 de nou-născuți și reprezintă cea mai frecventă boală peroxizomală. Aceasta este cauzată de mutații ale genei ABCD1, localizată pe cromozomul X, genă responsabilă de sinteza unei proteine peroxizomale denumită ALDP (proteina adrenoleucodistrofiei), cu rol în metabolismul acizilor grași cu lanț foarte lung (VLCFA).
La pacienții care suferă de adrenoleucodistrofie, această proteină este deficitară, astfel încât VLCFA nu sunt eliminați și se acumulează progresiv la nivelul glandei suprarenale și a sistemului nervos central și periferic, conducând la inflamație și distrucție a mielinei, cu un impact important asupra funcționalitații nervoase.
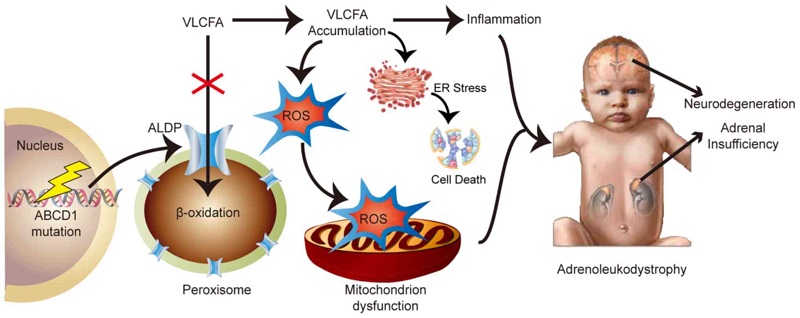
Boala se transmite recesiv legat de cromozomul X, afectând în special sexul masculin și are mai multe forme, dintre care adrenoleucodistrofia cerebrală (CALD) este cea mai comună și cea mai severă.
Aproximativ 35% dintre băieții diagnosticați cu adrenoleucodistrofie vor dezvolta și afectare cerebrală (CALD) în perioada copilăriei. Netratată, aceasta are o speranță de viață de aproximativ 5 ani de la diagnostic.
Până în acest momement nu există niciun tratament aprobat pentru această afecțiune, singura intervenție terapeutică disponibilă fiind transplantul alogen de celule stem. Această procedură comportă însă numeroase provocări și este rezervată cazurilor diagnosticate precoce.
Un procent foarte mare de pacienți rămâne în continuare fără opțiuni de tratament.
Cum funcționează terapia genică în adrenoleucodistrofie?
Skysona este o terapie genică ex vivo, care implică prelevarea și modificarea celulelor stem hematopoietice ale pacientului. Tratamentul începe cu prelevarea de măduvă osoasă imatură de la pacient; celulele sunt modificate ulterior cu ajutorul unui vector viral, un lentivirus, care conține o copie funcțională a genei ABCD1, care va fi astfel introdusă în genomul celulelor. Când aceste celule modificate sunt infuzate în organismul pacientului, intravenos, ele se răspândesc la nivelul întregului organsim și se vor transforma în diferite tipuri de celule sănătoase adulte, inclusiv celule nervoase capabile să producă proteina ALD care este deficitară la acești pacienți. Astfel, rezultatul va consta în dobândirea abilității de a degrada VLCFA acumulați și prezervarea funcțiilor neurologice.
Skysona se administrează în doză unică, într-un centru specializat, de către medici cu experiență în tratarea pacienților cu adrenoleucodistrofie, în transplant de măduvă osoasă și în utilizarea terapiilor genice.
Skysona a fost acceptat în cadrul PRIME, un program de suport dezvoltat de către EMA pentru noi terapii promițătoare care se adresează unor nevoi medicale neacoperite până în prezent și de asemenea, i s-a oferit statutul de medicament orfan.
Rezultatele terapiei în studii clinice
Recomandarea EMA pentru punerea pe piață a acestei terapii genice are la bază datele dintr-un studiu clinic de fază 2/3 pe un lot de 32 pacienți de sex masculin cu adrenoleucodistrofie cerebrală, cu vârste de până la 18 ani. Studiul ALD-102 a evaluat eficacitatea și siguranța transplantului alogen cu celule stem hematopoietice modificate ex-vivo cu ajutorul vectorului lentiviral.
90% dintre pacienții tratați cu Skysona în cadrul studiului clinic ALD-102 au îndeplinit obiectivul primar, supraviețuirea fără dizabilitate funcțională majoră, la 2 ani de urmărire.
În plus, rezultatele parțiale ale studiului LTF-304, care își propune urmărirea pacienților pe termen lung, sugerează că terapia genică a demonstrat un efect durabil în termeni de supraviețuire fără dizabilitate funcțională majoră pe o perioadă de aproape 7 ani.
Cea mai severă reacție adversă a tratamentului în cadrul studiilor clinice pentru Skysona a fost pancitopenia. Alte reacții adverse observate au fost cistita virală sau emeza.
Nu au fost raportate cazuri de boală grefă-contra-gazdă, rejet de grefă sau mortalitate în legătură cu transplantul pentru cei 51 de pacienți tratați cu Skysona din cadrul tuturor studiilor clinice. În plus, nu au fost semnalate nici cazuri de mutageneză inserțională mediate de vectorul viral, precum mielodisplazii, leucemii sau limfoame, asociate tratamentului cu Skysona.
Date adiționale legate de eficacitate și siguranță pe termen lung sunt în continuare colectate și revăzute periodic de către EMA.
Care sunt pașii următori?
Opinia adoptată de CHMP privind recomandarea pentru emiterea autorizației de punere pe piață a terapiei genice Skysona, un produs medical avansat (ATMP), reprezintă un pas intermediar important către accesul pacienților la acest tratament. În continuare se așteaptă adoptare deciziei de către Comisia Europeană. O dată aprobat, deciziile privind prețul și rambursarea vor avea loc la nivelul fiecărui stat membru, luând în considerare utilitatea tratamentului la nivelul fiecărui sistem de sănătate al țării respective.
Citește și:
- #BiotechWeek2020. Terapiile genice: cum a evoluat domeniul și care sunt cele mai importante lecții în ultimii 30 de ani?
- 4 dintre cele 10 noi tratamente recomandate spre aprobare de EMA în luna octombrie sunt produse medicale bazate pe terapii avansate: terapii genice, celulare și tehnologia de interferență ARN
- #BiotechWeek2020. Medicamentele biologice: ultimele dezvoltări în domeniu și cele mai recente aprobări

