Vaccinul AstraZeneca contra COVID-19 a primit autorizație condiționată de punere pe piață în UE
Comisia Europeană a acordat autorizația condiționată de punere pe piață pentru vaccinul contra COVID-19 produs de AstraZeneca/Oxford (ChAdOx1 nCoV-19). Pe 29 ianuarie, Comitetul pentru Produse Medicale de Uz Uman din cadrul Agenției Europene a Medicamentului (CHMP) a ajuns la concluzia că beneficiile vaccinului depășesc riscurile și a recomandat autorizarea acestuia pentru imunizarea persoanelor cu vârste de peste 18 ani. Acesta este al treilea vaccin COVID-19 pe care EMA l-a recomandat pentru autorizare în UE.
„Asigurarea accesului la vaccinuri sigure pentru cetățenii europeni este prioritatea noastră. Odată cu autorizația vaccinului AstraZeneca, 400 de milioane de doze vor fi disponibile în Europa.” – Ursula von der Leyen, Președintele Comisiei Europene
Eficacitatea și siguranța vaccinului au fost demonstrate în 4 studii randomizate derulate în Marea Britanie, Africa de Sud și in Statele Unite ale Americii, care au inclus în total aproximativ 24.000 de persoane. Rezultatele dintr-o analiză interimară a acestor studii au fost publicate în Lancet și arătau o eficacitate a generală a vaccinului de 70,4%. O schemă de vaccinare în care se utilizează inițial o jumătate de doză, urmată de o doză întreagă a condus la obținerea unei eficacități de până la 90%. Utilizarea schemei cu două doze complete a condus la o eficacitate de 62%.
Autorizarea din UE s-a bazat pe date din două studii: COV002 (derulat în Regatul Unit) și COV003 (din Brazilia). În celelalte 2 studii s-au înregistrat mai puțin de 6 cazuri COVID-19, ceea ce nu a fost suficient pentru a evalua cu acuratețe eficacitatea vaccinului în prevenția bolii. Rezultatele arată că vaccinul determină o reducere de 59,5% a numărului de cazuri COVID-19 simptomatice la persoanele care au primit vaccinul (64 din 5.258 au făcut infecție SARS-CoV-2 simptomatică), comparativ cu cei care nu au primit vaccin (154 din 5.210 au făcut infecție SARS-CoV-2 simptomatică).

Participanții din aceste studii aveau vârste cuprinse între 18 și 55 de ani. Având în vedere că studiile anterioare arată un profil bun al vaccinului în ceea ce privește imunogenitatea, inclusiv la persoanele de peste 55 de ani, și luând in considerare experiența cu alte vaccinuri, comitetul EMA a ajuns la concluzia că vaccinul oferă protecție și pentru aceste categorii de populație.
CHMP a luat în considerare schema de administrare care implică două doze standard (prima doză întreagă și a doua doză la 4-12 săptămâni).
„Vaccinul poate fi administrat persoanelor care au avut COVID-19 în antecedente. Nu se știe încă dacă poate reduce transmiterea infecției, însă cercetările continuă în acest sens. Vaccinul este considerat eficient împotriva noilor variante, iar situația este monitorizată în continuare. Platforma folosită permite adaptarea vaccinului în caz de nevoie”, a declarat Bruno Sepodes (Vicepreședinte CHMP) în timpul conferinței de presă.
Pe 30 decembrie, Marea Britanie a devenit prima țară care a autorizat utilizarea de urgență a vaccinului Oxford-AstraZeneca, la pacienții cu vârsta de 18 ani și peste.
Cum funcționează vaccinul?
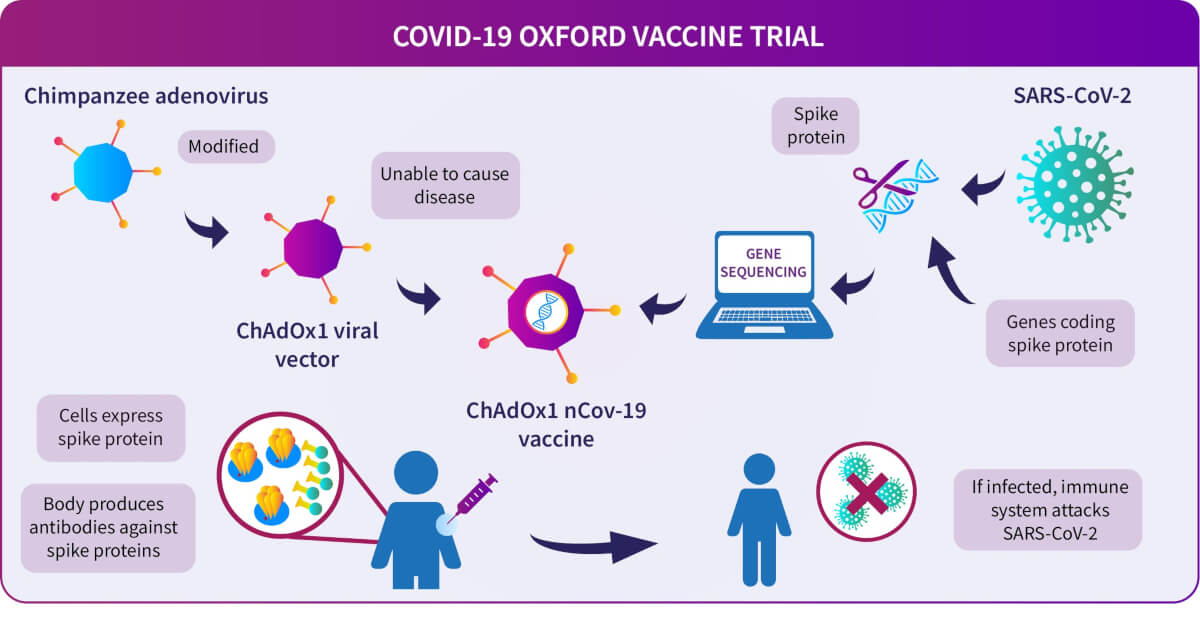
Vaccinul AstraZeneca folosește un vector viral (un virus din familia adenovirusurilor) pentru a livra o genă care codifică proteina spike în organismul uman. Adenovirusul folosit ca vector pătrunde în celulele umane, dar nu se poate replica, nu este infecțios. Gena care codifică proteina spike din structura SARS-CoV-2 este introdusă sub forma unui fragment de ADN dublu catenar. După ce vaccinul este administrat, acesta intră în celule și pătrunde la nivelul nucleului. Gena este copiată într-o moleculă de ARN care iese din nucleu ulterior și ajunge la nivelul ribozomilor unde se produce proteina S. Sistemul imun va detecta această structură antigenică și se vor produce anticorpi și limfocite T. Vaccinul AstraZeneca Oxford foloseste o versiune modificată a unui adenovirus (ChAdOx1) care provoacă infecții respiratorii la cimpanzeu.
Ce conține prospectul?
Vaccinul este indicat pentru imunizarea activă cu scopul prevenției bolii COVID-19, la persoane cu vârsta de peste 18 ani.
Acesta se administrează în două doze a câte 0,5 ml, a doua doză fiind administrată la interval de 4-12 săptămâni. Administrarea se face intramuscular, preferabil la nivelul mușchiului deltoid. Vaccinul se poate păstra timp de 6 luni, la o temperatură cuprinsă între 2-8 °C.
Se recomandă precauție în următoarele situații:
- Dacă persoanele au prezentat reacții alergice în antecedente;
- Vaccinarea trebuie amânată la persoane cu boli acute, cu febră sau infecții acute. Prezența unei infecții minore, cu febră ușoară, nu necesită amânarea vaccinării;
- Persoanele care au tulburări de coagulare sau care primesc tratament cu anticoagulant;
- Persoanele care primesc tratament cu imunosupresoare.
Vaccinul este contraindicat persoanelor care au alergii la substanța activă sau la oricare dintre excipienți.
Cele mai frecvente reacții adverse raportate includ: durere la locul injectării, cefalee, fatigabilitate, mialgii, febră, frisoane. Majoritatea reacțiilor adverse sunt ușoare sau moderate și de obicei dispar în decurs de câteva zile. După a doua doză sunt raportate mai puține reacții adverse și mai ușoare. De asemenea, acestea sunt mai puțin frecvente la persoanele de peste 65 de ani. Profilul de siguranță a fost similar indiferent dacă persoanele au avut sau nu infecție cu SARS-CoV-2 în antecedente.
Siguranța și eficacitatea vaccinului pentru populația pediatrică nu a fost încă evaluată. Nu a fost studiată administrarea concomitentă a altor vaccinuri.
Studiile preclinice arată că vaccinul nu afectează dezvoltarea fetală și nu afectează fertilitatea. Urmează ca vaccinul să fie evaluat în ceea ce privește eficacitatea și siguranța la femeile gravide. Se recomandă ca la această categorie de populație, vaccinul să fie administrat în funcție de particularitățile cazului, luându-se în considerare beneficiile și riscurile.
Urmăriți o ediție a emisiunii Raportuldegarda LIVE, în care Dr. Marius Geantă, Președintele Centrului pentru Inovație în Medicină comentează autorizația celui de-al treilea vaccin COVID-19 în UE:
Citește și:
- Vaccinul ARNm produs de Moderna își menține eficacitatea împotriva noilor variante SARS-CoV-2
- Vaccinul Pfizer/BioNTech contra COVID-19 a primit autorizație condiționată de punere pe piață în UE

