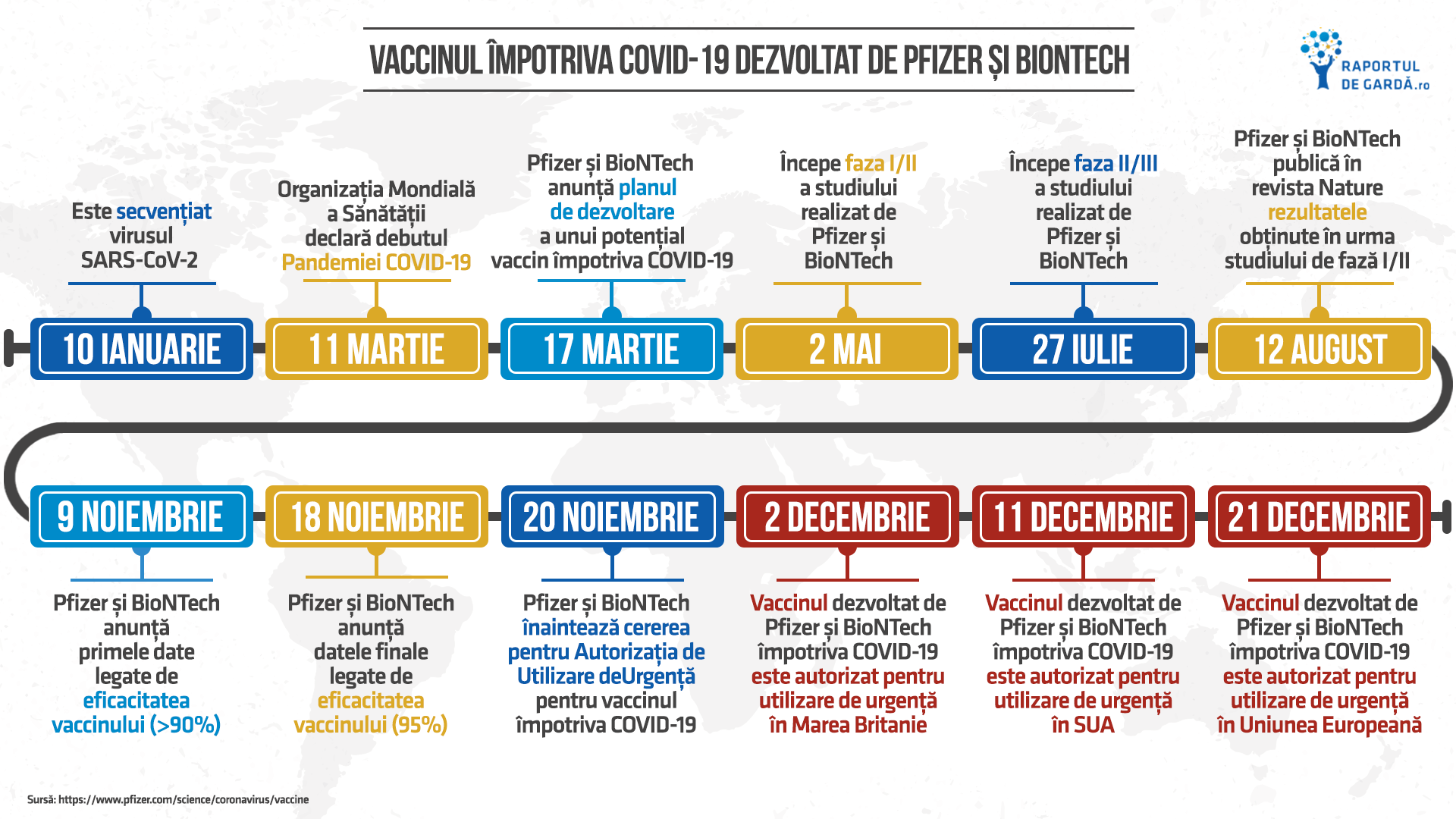
Vaccinul Pfizer/BioNTech contra COVID-19 a primit autorizație condiționată de punere pe piață în UE
Comisia Europeană a acordat pe 21 decembrie autorizația condiționată de punere pe piață pentru vaccinul produs de Pfizer/BioNTech, sub numele de Comirnaty (BNT162b2), cu indicație în imunizarea activă pentru prevenția bolii COVID-19, la persoanele cu vârste de peste 16 ani. Decizia a venit în urma recomandării Comitetului pentru Produse Medicale de Uz uman (CHMP) din cadrul Agenției Europene a Medicamentului (EMA), care în aceeași zi a ajuns la concluzia că beneficiile vaccinului depășesc riscurile.
Studiul de fază 3 care stă la baza aprobării condiționate de punere pe piață a vaccinului Pfizer/BioNTech a inclus aproape 44.000 de persoane, fiind unul dintre cele mai ample studii pe care Agenția Europeană a Medicamentului le-a analizat pentru un vaccin.
„În mai puțin de un an, un vaccin este autorizat pentru o nouă boală. Am fost ghidați de puterea dovezilor științifice și nimic altceva. Vaccinul întrunește standardele UE pentru siguranță, eficacitate și calitate” – Emer Cook, directorul Agenției Europene a Medicamentului
Pfizer și BioNTech vor începe distribuirea primelor doze de vaccin imediat la nivelul UE. În noiembrie 2020, cele două companii au ajuns la un acord cu Comisia Europeană pentru a distribui 200 milioane de doze de vaccin în 2020 și 2021 cu opțiunea pentru a produce încă 100 de milioane de doze adiționale.
Informații despre produs
Substanța activă este ARNm care codifică proteina spike. După diluție, flaconul conține 5 doze de 0,3 mL, cu 30 micrograne de ARNm fiecare.
Alte ingrediente:
- ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate) (ALC-0315)
- 2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide (ALC-0159)
- 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC)
- Colesterol
- Clorură de potasiu
- Clorură de sodiu
- Dihidrogen fosfat de potasiu
- Fosfat disodic dihidrat
- Sucroza
Vaccinul se administrează intramuscular, în două doze, la interval de 3 săptămâni. Acesta se stochează la temperaturi cuprinse intre -90 și -60 grade.
În prospectul vaccinului sunt menționate o serie de precauții care vizează:
- Persoanele cu istoric de alergii (reacții alergice severe după alt vaccin sau după o doză din acest vaccin)
- Cazurile de infecții acute cu febră înaltă (febra ușoară sau o infecție ușoară de căi aeriene superioare nu contraindică vaccinul);
- Persoanele care primesc anticoagulant, care au trombocitopenie care au o tulburare de coagulare precum hemofilia;
- Persoanele imunosupresate, precum cele cu infecție HIV sau care urmează tratament cu medicamente imunosupresive;
- Cazurile de reacții asociate anxietății ca răspuns la injecție (reacții vaso-vagale)
Efectele secundare frecvente (care apar la mai mult de 1 din 10 persoane) includ:
- reacții la locul de injectare (durere, tumefacție)
- cefalee
- durere musculară
- durere articulară
- frison, febră
Efecte secundare care afectează cel mult 1 din 10 persoane:
- înroșirea zonei de injectare
- greața
Efectele secundare mai puțin întâlnite (cele care afectează pana la 1 din 100 de persoane) includ:
- tumefacția ganglionilor limfatici
- insomnie
- durere la nivelul membrului superior
Vaccinul este contraindicat persoanelor alergice la substanța activă sau la oricare componentă din vaccin.
Nu se cunoaște încă durata protecției oferită de vaccin. Persoanele vaccinate în studiul clinic vor fi urmărite în continuare, pentru încă 2 ani pentru a se obține mai multe informații. De asemenea, studiile vor continua pentru a evalua eficacitatea și siguranța vaccinului în populația pediatrică și la femeile gravide.
Decizia pentru utilizarea vaccinului la gravide trebuie adaptată fiecărui caz, la sfatul medicului, în urma analizării riscurilor și beneficiilor.
Mai multe detalii despre această aprobare:
Comirnaty folosește tehnologia ARN mesager, vaccinul conține instrucțiunile genetice necesare pentru producerea unei componente cheie din structura virusului SARS-Cov-2 – proteina spike – responsabilă de pătrunderea în celulele umane. Această proteină este importantă pentru că ea conduce la producția de anticorpi neutralizanți. În urma vaccinării, celulele vor traduce mesajul codificat în ARN-ul mesager și vor produce temporar proteina spike. Astfel, sistemul imun va recunoaște proteina ca fiind străină, va produce anticorpi și va activa limfocitele T. Dacă o persoană vine în contact cu virusul, sistemul imun îl va recunoaște. Fragmentul de ARN este distrus la scurt timp după vaccinare, nu există riscul ca acesta să pătrundă în nucleul celulei și să interacționeze cu ADN-ul.
Datele din studii clinice
Eficacitatea a fost evaluată în cadrul unui grup de peste 36.000 de persoane cu vârste de peste 16 ani (inclusiv un grup reprezentativ de persoane de peste 75 de ani) care nu au mai avut infecție COVID-19 în antecedente. Studiul a arătat o reducere cu 95% a numărului de cazuri simptomatice de COVID-19 în grupul care a primit vaccinul (8 cazuri în grupul care a primit vaccinul versus 162 în grupul placebo). S-a observat și o eficacitate în jur de 95% la persoane la risc de a face o formă severă (persoane cu astm, diabet zaharat, hipertensiune, obezitate).
Profilul de siguranță determinat în urma unei perioade de urmărire de 2 luni a fost similar cu cel al altor vaccinuri. Nu au existat efecte secundare la cele 545 persoane care au primit vaccinul și au avut infecție COVID-19 în antecedente.
Reacțiile secundare raportate în studii clinice includ: durere la locul de injectare, oboseală, dureri de cap, durere musculară, febră, frisoane, înroșirea sau tumefacția zonei de injectare, greață și limfadenopatie.
Eficacitatea vaccinului contra unei noi tulpini a virului
Recent, în Sudul Angliei s-a observat o creștere rapidă a numărului de cazuri COVID-19, asociată cu apariția unei noi tulpini a virusului, care se caracterizează prin mai multe modificări la nivelul proteinei spike, dar și în alte regiuni genomice. Această situație este intens monitorizată de autoritățile britanice, dar și de cele internaționale. Conform directorului EMA, în acest moment nu există dovezi că vaccinul nu ar funcționa împotriva acestei noi tulpini.
De asemenea, Pfizer și Moderna studiază în prezent eficacitatea vaccinului asupra noii tulpini. SARS-Cov-2 a mai suferit mutații de-a lungul ultimelor luni, însă aceste variante nu au influențat eficacitatea vaccinurilor, conform datelor celor două companii producătoare.
Citește și
- Cum a fost posibilă dezvoltarea atât de rapidă a vaccinurilor contra COVID-19?
- Cum funcționează tehnologia ARN mesager folosită în vaccinurile COVID-19?
- FDA a autorizat vaccinul Pfizer/BioNTech pentru utilizare de urgență în SUA

