Cum a fost posibilă dezvoltarea atât de rapidă a vaccinurilor contra COVID-19?
La mai puțin de un an de la raportarea primului caz de COVID-19, există deja un vaccin disponibil pentru prevenția acestei infecții, situație excepțională, fără precedent în lumea medicală. Vaccinul împotriva COVID-19, de tip ARNm, realizat de Pfizer/BioNTech a primit aprobare pentru utilizare în regim de urgență în Marea Britanie pe 2 decembrie și pe 11 decembrie în SUA. Acesta este primul vaccin autorizat care folosește tehnologia ARN mesager.
Răspunsul în cazul pandemiei COVID-19 fost mult mai rapid decât în trecut datorită disponibilității de colaborare intersectorială, dar și datorită îmbunătățirii mijloacelor de comunicare și împărtășire a datelor. Dezvoltarea vaccinurilor împotriva SARS-CoV-2 a presupus eforturi suplimentare și mobilizarea resurselor în mod simultan.
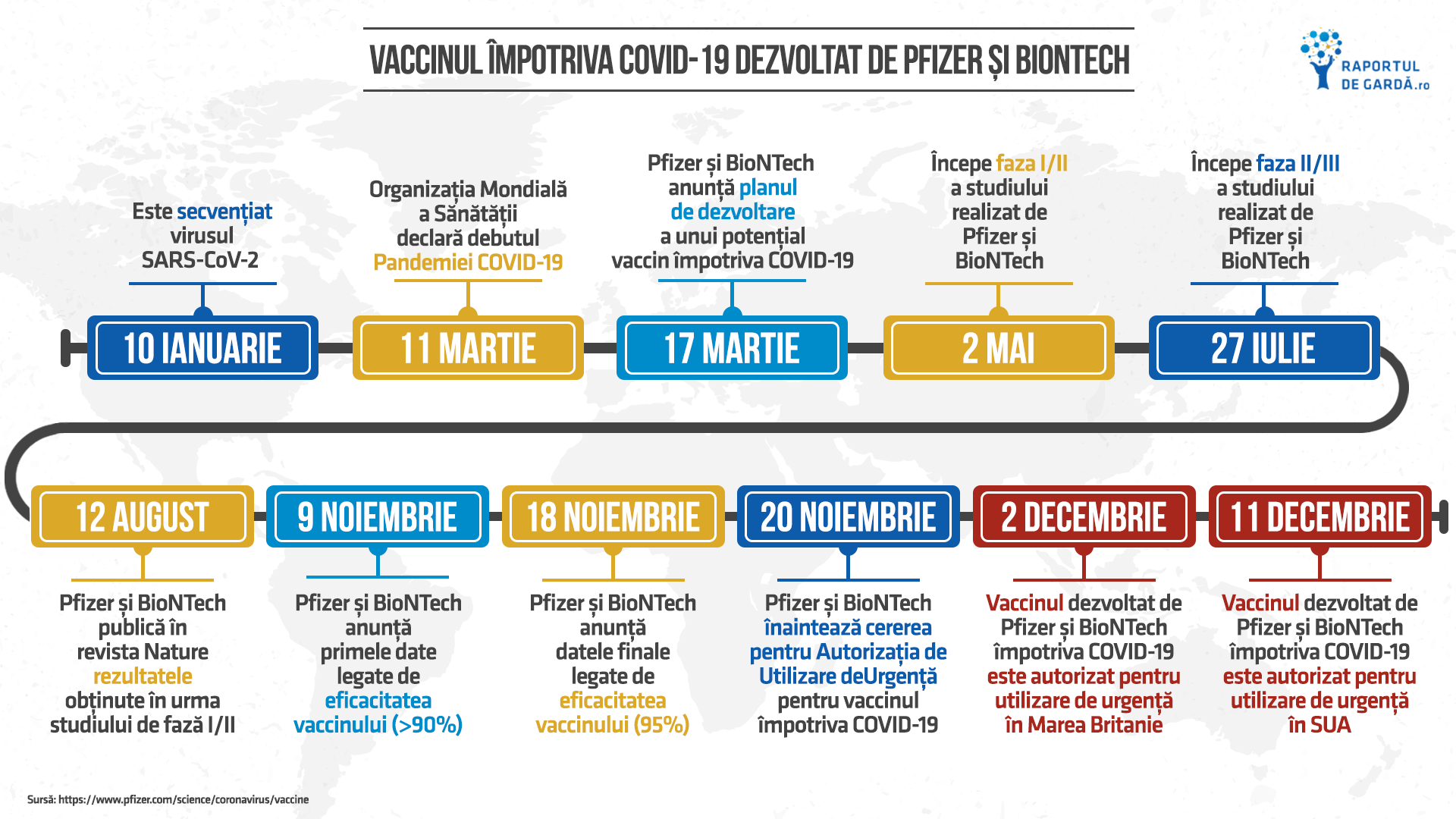
Organizația Mondială a Sănătății a declarat pandemie pe 11 martie 2020, iar șase zile mai târziu companiile Pfizer și BioNTech anunțau deja planul de dezvoltare a unui potențial vaccin împotriva COVID-19.
Dezvoltarea unui vaccin presupune existența unei etape preclinice, de laborator, în care sunt realizate testări ale moleculelor/particulelor virale sau subvirale candidate, pe culturi de celule și animale de laborator, urmată de desfășurarea studiilor de fază 1,2 și 3, pe loturi de pacienți.
Etapa preclinică a dezvoltării vaccinurilor se derulează, de obicei, pe parcursul mai multor ani. În cazul vaccinului împotriva SARS-CoV-2, această fază de cercetare în laborator a fost mult scurtată, prin concurența a numeroși factori favorizanți: progresul tehnologic, alocarea eficientă de resurse, colaborarea cu autoritățile de reglementare, cooperarea dintre companiile implicate în cursa pentru obținerea primului vaccin împotriva SARS-CoV-2, transparența și accesul facil la date, precum și utilizarea experienței anterioare de cercetare a altor coronavirusuri, în special SARS-CoV, și a tehnologiei ARNm în realizarea vaccinurilor.
Momentele cheie în dezvoltarea preclinică vaccinului împotriva SARS-CoV-2 au fost reprezentate de:
-
- Identificarea și izolarea SARS-CoV-2;
- Secvențierea genomului SARS-CoV-2;
- Descrierea structurii și funcției proteinelor care alcătuiesc noul coronavirus (mai ales proteina spike);
- Descrierea tipului de răspuns imun determinat de antigenele virusului SARS-CoV-2.
Primele cazuri de COVID-19 au fost raportate în decembrie 2019. Ulterior, la doar o lună de la apariția acestora, genomul noului virus SARS-CoV-2 a fost secvențiat. Progresele și dezvoltarea susținută a tehnologiei și a domeniului genomicii au fost cele care au permis descoperirea structurii noului coronavirus într-un timp atât de scurt. Comparativ cu epidemia cu virusul SARS din 2003, în cazul pandemiei COVID-19, raportarea cazurilor și implicarea autorităților din domeniul sănătății la nivel internațional s-au petrecut mult mai rapid. Astfel, această colaborare internațională, precum și progresele științifice și tehnologice din ultimii 17 ani de la epidemia SARS, au permis secvențierea genomului SARS-CoV-2 într-un timp record. În cazul epidemiei SARS din 2003, secvențierea genomului a necesitat 6 luni.
Structura și funcția proteinei spike
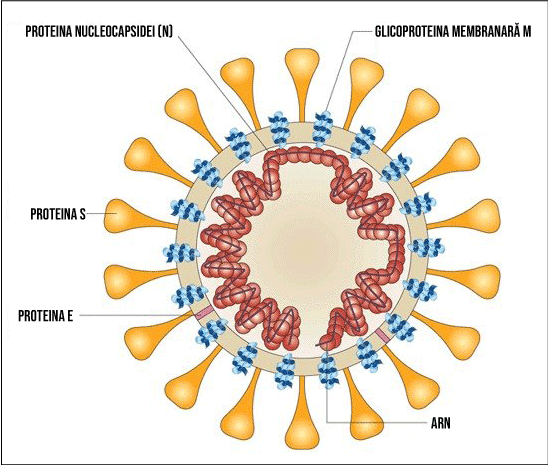
Virusul SARS-CoV-2 este alcătuit din 4 proteine structurale: proteina S (spike), proteina E (envelope), proteina M (membrane) și proteina N (nucleocapsid).
Proteina spike este formată prin unirea a 3 lanțuri polipeptidice (structură trimetrică). Întreaga structură tridimensională proteică este împărțită în două subunități, S1 și S2, care, împreună, participă la realizarea funcției proteinei S: atașarea la receptorul celular, fuziunea anvelopei virale cu membrana celulei gazdă, pătrunderea intracelulară. Astfel, cu ajutorul acestei proteine structurale, este inițiată infecția SARS-CoV-2.
Subunitatea S1 asigură atașarea la receptorul de pe suprafața celulei gazdă (ACE2 – angiotensin-converting enzyme 2) prin intermediul unui fragment numit domeniu de legare a receptorului (RBD). Subunitatea S2 este implicată în medierea fuziunii cu membrana celulară.
Interacțiunea ACE2-RBD este urmată de modificări conformaționale complexe ale proteinei S. Acestea sunt necesare pentru realizarea fuziunii cu membrana celulei gazdă și, practic, determină inițierea infecției cu SARS-CoV-2 la nivelul tractului respirator.
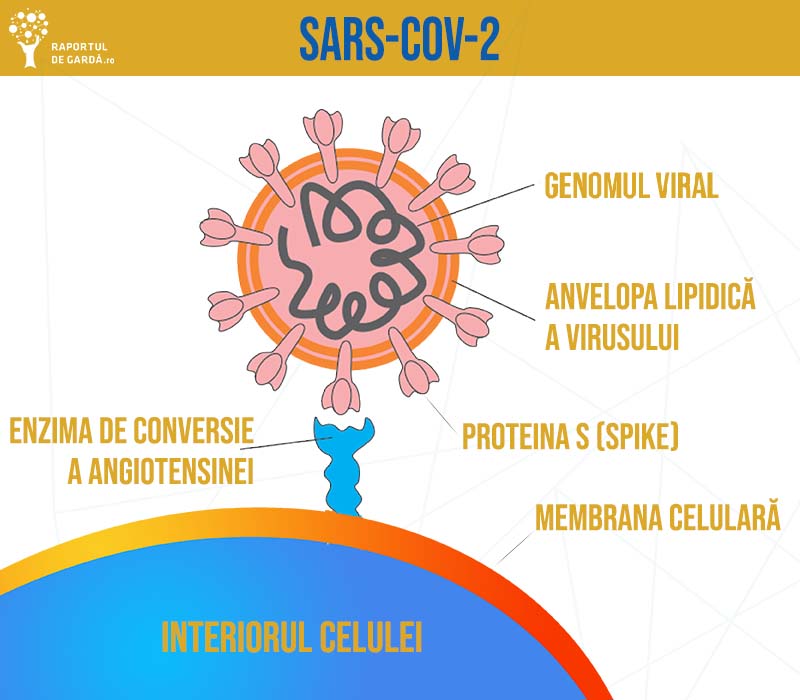
Consecința este reprezentată de pătrunderea intracelulară a virusului, unde acesta utilizează celula gazdă pentru a se replica, proteinele structurale sunt sintetizate și împachetate, are loc asamblarea particulelor virale, care apoi sunt eliberate.
Întregul ciclu replicativ al SARS-CoV-2 depinde de integritatea procesului de a pătrunde în citoplasma celulei gazdă. Fără ca virusul să ajungă intracelular, infecția nu poate avea loc. Deoarece proteina spike este principalul mediator al acestui proces, reprezintă structura țintă a dezvoltării de potențiale vaccinuri și terapii împotriva COVID-19.
Prin urmare, identificarea proteinei spike în februarie 2020 a fost un moment cheie în dezvoltarea vaccinului împotriva COVID-19, deoarece a permis depistarea unui proces asupra căruia se poate interveni spre a îl întrerupe.
Dezvoltarea anticorpilor neutralizanți
Proteina S reprezintă o importantă componentă a virusului care acționează precum un antigen și stimulează răspunsul imun, rezultând producția de anticorpi împotriva acestei proteine structurale, precum și expansiunea limfocitelor T antigen specifice. Anticorpii care apar împotriva proteinei spike sunt protectori față de COVID-19.
Atașarea anticorpilor la proteina spike împiedică interacțiunea dintre aceasta și receptorul celular (ACE2), apariția modificărilor conformaționale și fuziunea cu membrana celulei gazdă. Consecința este reprezentată de prevenirea apariției infecției, ceea ce justifică îndreptarea cercetării în direcția identificării unor medicamente sau vaccinuri care se adresează proteinei S.
RBD reprezintă o componentă imunologică foarte importantă a proteinei S, determinând un important răspuns imun atât prin formarea de anticorpi, cât și prin stimularea proliferării limfocitelor T antigen-specifice. Anticorpii care blochează RBS împiedică legarea proteinei spike la ACE2, în timp ce imunoglobulinele împotriva S2 sau a altor porțiuni ale S1 nu permit apariția modificărilor conformaționale și fuziunea cu membrana celulară.
Dacă această proteină structurală este reprodusă cu maximă fidelitate, un răspuns imun optim poate fi declanșat cu ajutorul unui vaccin. Tehnologia ARNm este o metodă care permite sinteza proteinei S cu o acuratețe ridicată, ceea ce justifică rezultatele favorabile în urma testării in vivo a acestei metode.
ARNm – vaccinul care poate asigura o producție rapidă în fața unei crize de sănătate publică
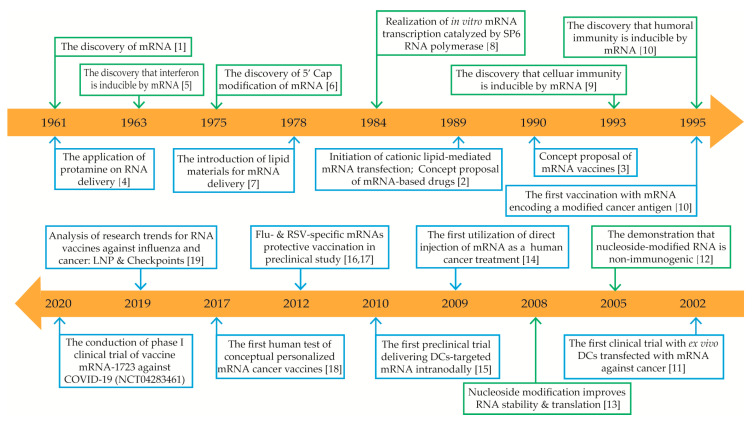
Utilizarea ARN-ului mesager (ARNm) pentru obținerea unui vaccin nu reprezintă o idee care a apărut în contextul unei pandemii. Această tehnologie de producere a vaccinurilor se află în proces de cercetare de aproximativ 20 de ani. Deși până la BNT162b2 nu fusese aprobat niciun vaccin de tip ARNm, toate cunoștințele necesare pentru optimizarea acestei metode erau acumulate.
ARNm reprezintă o copie a informației genetice prezente la nivelul unei gene. Pe baza moleculei de ARNm poate fi sintetizată proteina codificată de secvența genetică pe care o conține. Un vaccin dezvoltat prin această tehnologie se bazează pe producția proteinei virale de interes de către aparatul de sinteză proteică din citoplasma celulei gazdă, pe baza informației din ARNm. Sistemul imun sesizează prezența proteinei străine și răspunde prin producția de anticorpi și expansiunea limfocitelor T.
Informații despre cum funcționează vaccinurile de tip ARNm aici.
În lipsa realizării unor procese de optimizare, utilizarea ARNm pentru obținerea unui vaccin nu poate fi eficientă. Creșterea expresiei proteice și stabilității moleculei de ARN a necesitat un proces de cercetare îndelungat pentru a identifica toate condițiile care trebuie îndeplinite pentru a obține un vaccin eficace in vivo, dar și cum trebuie adresate toate aceste dificultăți. La îmbunătățirea tehnologiei ARNm au contribuit foarte mult studiile realizate de Dr. Katalin Kariko, care a cercetat această moleculă timp de 40 de ani.
Principalele modificări care au permis obținerea unui vaccin de tip ARNm eficient împotriva COVID-19 s-au adresat creșterii expresiei proteinei și stabilității moleculei. Optimizarea s-a realizat prin alterarea secvenței elementelor componente ale ARN-ului mesager (regiunile netranslatate – UTRs, secvența care codifică antigenul, învelișul 5`, coada poliadeninică), obținerea unei purității ridicate, asamblarea în particule nanolipidice și utilizarea unei căi de administrare adaptate scopului vaccinului. Detalii aici.
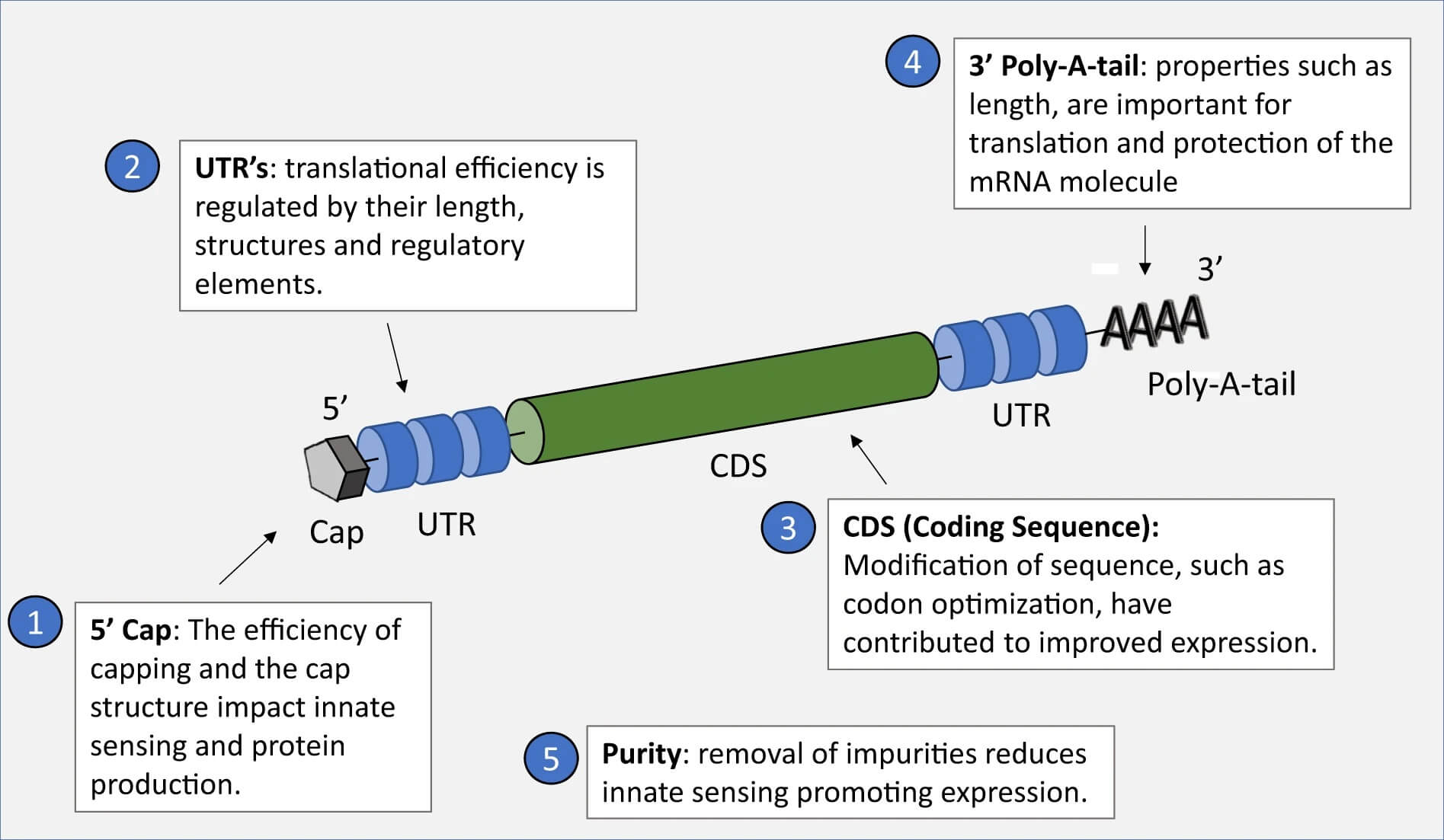
Vaccinul ARNm împotriva SARS-CoV-2
Vaccinul BNT162b2 dezvoltat de Pfizer/BioNTech conține ARNm care codifică proteina spike, antigenul viral important pentru stimularea răspunsului imun și apariția anticorpilor de tip protector față de COVID-19. Este de tip non-replicativ, conține nucleozide modificate și alterări ale RBD care îi cresc imunogenitatea. Prin administrarea acestui vaccin este mimată infecția cu SARS-CoV-2, dar în locul întregului virus este sintetizată o moleculă cheie pentru stimularea sistemului imun, fără a determina apariția COVID-19.
Moleculele de ARNm sunt împachetate în particule nanolipidice și administrate prin injectare la nivelul brațului, unde celulele musculare utilizează acest ARNm pentru a produce proteina spike. Două doze sunt necesare pentru a obține protecția împotriva SARS-CoV-2, administrate la un interval de 21 de zile. Este foarte important ca vaccinul să fie depozitat în condiții corespunzătoare: în ambalajul original, ferit de lumină, la temperaturi între -80 și -60 °C.
Pentru a obține o protecție eficientă împotriva COVID-19, nu este necesară doar apariția de anticorpi neutralizanți împotriva SARS-CoV-2, ci și a limfocitelor T antigen specifice. Studiile clinice au evidențiat că majoritatea subiecților vaccinați au prezentat o expansiune a limfocitelor antigen specifice pentru RBD. Prin urmare, această condiție importantă este îndeplinită prin utilizarea unui vaccin dezvoltat prin platforma ARNm.
Fiind un virus cu genom ARN, SARS-CoV-2 prezintă o rată crescută a apariției mutațiilor. Dacă acestea au loc la nivelul subunității S1 a proteinei spike, se pot asocia cu o afinitate ridicată față de receptorul ACE2 și pot afecta eficiența vaccinului. Tehnologia ARNm este, însă, flexibilă și, conform declarațiilor reprezentanților Pfizer, vaccinul de tip ARNm poate fi adaptat dacă apar astfel de mutații.
Informații despre vaccinul de tip ARNm împotriva COVID-19 aici.
Așadar, experiența în lucrul cu ARNm sintetic dezvoltată în urma a zeci de ani de cercetare a fost un element cheie care a contribuit la aprobarea în timp record a unui vaccin împotriva COVID-19, alături de obținerea rapidă a numeroase informații genetice, structurale și funcționale cu privire la SARS-CoV-2.
Cum au fost acumulate atât de multe informații despre SARS-CoV-2 în câteva luni
SARS-CoV-2 este un coronavirus, prin urmare se aseamănă structural și funcțional cu ceilalți membri ai acestei familii, în special cu SARS-CoV. Prin urmare, structura, modul de inițiere a infecției, ciclul replicativ, tipul de răspuns imun indus au putut fi anticipate pe baza cunoștințelor anterioare. Foarte importantă a fost secvențierea genomului SARS-CoV-2, care a putut semnala diferențele dintre acest nou virus și ceilalți membri ai familiei coronavirusurilor.
Structura și funcția proteinei spike din componența SARS era deja descrisă atunci când a fost identificat noul coronavirus. Secvența care codifică proteina S a SARS-CoV-2 este identică în proporție de aproximativ 75% cu cea a virusului SARS. Atașarea la ACE2 cu ajutorul proteinei spike, fuziunea anvelopei virale cu membrana celulei gazdă și pătrunderea virusului în citoplasmă are loc similar pentru SARS și SARS-CoV-2. Componenta imunodominantă a proteinei spike, domeniul de legare a receptorului, este însă mai puțin conservată (aproximativ 47% similară între SARS-CoV și SARS-CoV-2).
Răspunsul imun indus de proteina spike și componenta sa RBD, prin stimularea producției de anticorpi protectori și limfocite T antigen specifice, a fost, de asemenea, descris anterior pentru SARS-CoV.
Când SARS-CoV-2 a fost identificat, progresele tehnologice și alocarea eficientă a resurselor au făcut posibilă secvențierea rapidă a genomului, precum și identificarea elementelor structurale și a funcției acestora, permițând, pe baza experienței anterioare cu SARS-CoV și alte coronavirusuri să fie propuse metode de dezvoltare a unui vaccin care să prevină COVID-19.
Toți acești factori au permis scurtarea semnificativă a etapei preclinice de dezvoltare a vaccinurilor, care în mod tradițional se desfășura pe parcursul mai multor ani. Nu a fost pierdută calitatea studiilor de cercetare fundamentală, cantitatea datelor obținute este suficientă, ci doar a fost eficientizat la maxim procesul, situația fără precedent de colaborare între lumea științifică și autorități permițând parcurgerea unor etape în timp record.
Aspectele cheie prin care s-a câștigat foarte mult timp au fost posibile datorită căii de dezvoltare rapidă (fast-track), prevăzută în mecanismele de funcționare ale autorităților de reglementare (FDA – Food and Drug Administration și EMA – Agenția Europeană a Medicamentului), chiar pentru situațiile de urgență. Astfel, cercetarea și dezvoltarea candidaților pentru vaccinul COVID-19 au putut fi suprapuse etapelor de cercetare clinică prin studiile de fază I, II și III. În mod tradițional, în dezvoltarea unui produs farmaceutic prin calea standard, aceste etape se implementează secvențial, nu în paralel. Așadar, toate etapele au fost implementate și în cazul dezvoltării vaccinurilor anti COVID-19, dar acestea au putut fi desfășurate simultan (acolo unde erau prezente criterii de siguranță), prin alocarea unor resurse suplimentare considerabile din partea companiilor producătoare.
Vaccinurile COVID-19 vor fi aprobate în conformitate cu aceleași standarde de reglementare care se aplică tuturor medicamentelor din Uniunea Europeană. Chiar dacă dezvoltarea vaccinurilor se petrece în timpul unei crize de sănătate publică, autoritățile de reglementare analizează cu aceeași strictețe potențialele efecte adverse majore. Un exemplu demonstrativ al acestui principiu s-a petrecut în cazul vaccinului împotriva COVID-19 dezvoltat de către AstraZeneca/Oxford, AZD1222. Un proces de revizuire standard a fost declanșat pentru a permite unui comitet independent să revizuiască datele de siguranță ale unui singur eveniment al unei boli apărute în timpul studiului de fază III din Marea Britanie. Recomandările din aceste analize, susținute de autoritățile de reglementare internaționale, au confirmat siguranța reluării studiilor clinice.
Mai mult decât atât, dialogul continuu dintre autoritățile de reglementare și dezvoltatorii vaccinurilor au permis o evaluare continuă a datelor provenite din studiile vaccinurilor, pe parcursul implementării lor și nu odată cu finalizarea studiilor. Acest proces de evaluare face parte din calea rapidă de dezvoltare a produselor farmaceutice, numindu-se revizuire continuă (rolling review). Deoarece datele despre eficacitatea, siguranța și calitatea vaccinurilor COVID-19 au fost permanent evaluate de către autoritățile de reglementare în timp real, odată ce aceste date deveneau disponibile, timpii de evaluare au fost reduși în mod semnificativ. Acest lucru a fost posibil datorită mobilizării de resurse și eforturilor de colaborare susținute de actorii implicați în controlul pandemiei.
Un alt aspect care va permite disponibilitatea unor stocuri importante de vaccinuri în momentul aprobării, pentru a fi distribuite cât mai repede populației, este faptul că procesul de manufacturare a vaccinurilor a fost demarat încă din timpul studiilor de fază II. În calea standard de dezvoltare a vaccinurilor, producția stocurilor în vederea comercializării s-ar întâmpla doar după obținerea autorizațiilor. În cazul vaccinurilor COVID-19, dat fiind urgența de sănătate publică, companiile au putut începe producția vaccinurilor mai devreme deoarece Comisia Europeană a semnat contracte ferme pentru achiziționarea unor stocuri importante odată ce vaccinurile primesc autorizația din partea EMA. Rezumatul caracteristicilor produsului (prospectul) vaccinului este elaborat de compania producătoare și va fi revizuit și agreat de comitetele științifice ale EMA, urmând a fi publicat și diseminat ulterior obținerii autorizației de comercializare.
Toate aceste momente cheie au condus la emiterea primei autorizații pentru utilizare în regim de urgență acordată unui vaccin împotriva COVID-19 de către guvernul Marii Britanii, la mai puțin de un an de la declararea pandemiei SARS-CoV-2. Autoritățile britanice au publicat și prospectul pentru vaccinul COVID-19 produs de Pfizer/BioNTech pe care l-au aprobat.
Pe 20 noiembrie 2020, Pfizer și BioNTech au înaintat către EMA cererea pentru autorizarea condiționată de punere pe piață pentru vaccinul anti COVID-19. Autoritățile de reglementare Europene au anunțat comunicarea concluziilor evaluării vaccinului până la cel târziu 29 decembrie 2020, dat fiind revizuirea continuă ce a avut loc până în prezent. În Satele Unite, FDA a programat o reuniune a Comitetului său Consultativ pentru Vaccinuri și Produse Biologice Conexe pe 10 decembrie 2020 pentru a discuta despre solicitarea de emitere a autorizației în regim de urgență pentru același vaccin. Votul a fost în favoarea beneficiilor vaccinului dezvoltat de Pfizer/BioNTech față de riscuri, urmând acordarea autorizației de utilizare de urgență a BNT162b2 din partea FDA la data de 11 decembrie 2020.
O nouă etapă în dezvoltarea vaccinurilor
Tehnologia ARNm utilizată în dezvoltarea vaccinurilor a ajuns în punctul în care există suficientă experiență de cercetare a acestui domeniu pentru a permite producția unor vaccinuri sigure și eficace. Pe baza acestor constatări, ne așteptăm ca în următorii ani să asistăm la aprobarea mai multor vaccinuri de tip ARNm.
În prezent, metoda care utilizează ARN-ul mesager pentru dezvoltarea vaccinurilor este investigată pentru prevenirea unor boli infecțioase (rabia, gripa, Zika, Ebola, infecția HIV, infecția cu virusul sincițial respirator), dar și pentru prevenția și, mai ales, tratamentul cancerului (melanom, cancer mamar, leucemii, mezoteliom, glioblastom, carcinom renal, cancer pancreatic, cancer pulmonar non-microcelular, cancer prostatic, gliom malign, cancer ovarian). În studiile adresate proceselor neoplazice, este utilizat ARNm care codifică antigene asociate tumorilor, care stimulează răspunsul imun de tip celular să elimine sau să inhibe celulele maligne.
Tehnologia ARNm reprezintă o imensă oportunitate pentru producția unui vaccin antigripal ARNm sigur și eficient. Procesul utilizat în prezent pentru obținerea vaccinurilor antigripale este lent și laborios, însă poate fi accelerat semnificativ prin utilizarea ARNm. O altă direcție de dezvoltare a metodei ARNm constă în imunoprofilaxie și imunoterapie pasivă, prin utilizarea ARNm ce codifică lanțurile ușoare sau grele ale anticorpilor.
Citește și:
- FDA a autorizat vaccinul Pfizer/BioNTech pentru utilizare de urgență în SUA
- Cum funcționează tehnologia ARN mesager folosită în vaccinurile COVID-19?
- Cum se acordă autorizarea condiționată de punere pe piață în Uniunea Europeană pentru vaccinurile împotriva COVID-19?

