FDA acordă aprobarea completă pentru vaccinul Comirnaty, cu indicație în prevenția bolii COVID-19 la persoanele cu vârste de peste 16 ani
Update 23 august 2021. FDA (Food and Drug Administration) a aprobat vaccinul Comirnaty, produs de Pfizer/BioNTech, pentru prevenția bolii COVID-19 la persoanele cu vârste de peste 16 ani. Vaccinul este în continuare disponibil și sub autorizație în regim de urgență (EUA – emergency use authorisation) pentru categoria de vârstă 12-15 ani și pentru anumite categorii vulnerabile (pacienții imunosupresați).
Companiile producătoare au înaintat cererea pentru aprobarea completă – Biologics License Application (BLA) – pe 7 mai 2021. Noi date din studiul de fază III care a condus la emiterea EUA au stat la baza aprobării vaccinului, care include o perioadă mai mare de urmărire. 20.000 de persoane au primit vaccinul și alte 20.000 au primit placebo în cadrul studiului iar rezultatele au indicat o eficacitate de 91% în prevenția bolii COVID-19.
Aprobarea sub statutul BLA înseamnă că vaccinul întrunește toate standardele FDA pentru siguranță și eficacitate, pe baza datelor din studii preclinice, clinice, din datele reunite în perioada în care a fost aprobat doar sub EUA, precum și standardele de calitate legate de procesul de fabricație.
Autorizația în regim de urgență este acordată într-o criză sanitară cum este cazul pandemiei, însă în momentul în care starea de urgență este declarată încheiată, orice autorizație EUA își pierde valabilitatea. Starea de urgență a fost declarată în SUA pe 31 ianuarie 2020 și a fost actualizată de mai multe ori.
De asemenea, FDA a realizat o evaluare a profilului de siguranță al vaccinului, privind riscul de apariție a cazurilor de miocardită și pericardită iar datele acumulate până în prezent sugerează un risc mai mare în rândul bărbaților cu vârste de sub 40 de ani. Persoanele care au istoric de miocardită sau pericardită ar trebui să raporteze aceste evenimente înainte de a primi vaccinul, conform rezumatului caracteristicilor produsului.
Peste 60% din populația Statelor Unite ale Americii a primit cel puțin o doză de vaccin contra COVID-19. Un sondaj american arată că 3 din 10 persoane nevaccinate ar accepta vaccinul dacă acesta ar fi aprobat complet, nu doar în regim de urgență. Decizia FDA va facilita accesul la vaccin în cadrul diferitelor instituții și ar putea creșterea numărul persoanelor vaccinate. Aprobarea sub BLA înseamnă că medicii vor putea prescrie vaccinul „off-label”, în cazurile în care ar fi nevoie de o a treia doză.
Moderna, compania care produce un alt vaccin de tip ARNm contra COVID-19, a depus cererea pentru aprobarea integrală în luna iunie și decizia FDA este așteptată în următoarele luni.
11 decembrie 2020. Vaccinul de tip ARN mesager produs de Pfizer și BioNTech contra COVID-19 a primit autorizația de utilizare de urgență în SUA, cu indicație la persoanele cu vârsta de peste 16 ani. Decizia vine după ce, în data de 10 decembrie, comitetului consultativ pentru vaccinuri și produse biologice conexe din cadrul Centrului de Evaluare și Cercetare Biologică (CBER) a FDA a ajuns, după 10 ore de consultări publice, la concluzia că beneficiile vaccinului depășesc riscurile.
Vaccinul se administrează intramuscular, în două doze, la interval de 3 săptămâni. Flacoanele trebuie să fie menținute la temperaturi cuprinse între -80ºC până la -60ºC, ferite de lumină înainte de a fi utilizate.
Vaccinul COVID-19 produs de Pfizer-BioNTech conține:
- ARN mesager
- Lipide ( (4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate), 2 [(polyethylene glycol)-2000]-N,N-ditetradecylacetamide, 1,2-Distearoyl-sn-glycero-3- phosphocholine, cholesterol)
- Clorura de potasiu
- Fosfat de potasiu monobazic
- Clorură de sodiu
- Fosfat de sodiu dibazic
- Sucroză
Vaccinul este contraindicat persoanelor cu istoric de reacții alergice severe (ex. anafilaxie) la oricare dintre componente. Anafilaxia reprezintă o reacție alergică ce poate apărea în curs de secunde/minute de la expunerea la un agent declanșator.
Înainte de administrarea vaccinului există o serie de precauții. Persoanele ar trebui să anunțe medicul despre:
- Istoricul de alergii
- Starea febrilă
- Afecțiuni hematologice sau dacă persoana primește anticoagulant
- Imunosupresie sau administrarea de medicamente care pot influența sistemul imun
- Sarcina sau dacă o persoană intenționează să rămână însărcinată
- Dacă o persoană alăptează
- Daca a primit un alt vaccin COVID-19
Reacțiile adverse raportate în studii clinice includ: durere la locul de injectare, oboseală, dureri de cap, durere musculară, febră, frisoane, înroșirea sau tumefacția zonei de injectare, greață și limfadenopatie.
Reacțiile adverse alergice severe au fost raportate în urma administrării vaccinului în afara studiilor clinice. Semnele unei reacții adverse alergice severe pot include:
- Respirația îngreunată
- Tumefacția zonei feței și gatului
- Tahicardie
- Erupție cutanată
- Amețeală și slăbiciune
Nu există informații privind administrarea vaccinului Pfizer-BioNTech concomitent cu alte vaccinuri.
Durata protecției este încă necunoscută. Vaccinul Pfizer-BioNTECH este încă evaluat în studii clinice.
FDA a publicat atât documentele care conțin recomandări atât pentru cei care vor primi vaccinul cât și pentru profesioniștii din domeniul sănătății.
10.12.2020 Vaccinul Pfizer-BioNTech contra COVID-19 recomandat pentru aprobare de către Comitetul Independent pentru Vaccinuri al FDA
Comitetul consultativ pentru vaccinuri și produse biologice conexe din cadrul Centrului de Evaluare și Cercetare Biologică (CBER) a FDA a concluzionat la sfârșitul a zece ore de consultări publice că beneficiile vaccinului Pfizer-BioNTech depășesc riscurile, pregătind terenul pentru ca agenția americană să autorizeze utilizarea de urgență a vaccinului la persoanele cu vârsta peste 16 ani. Vaccinul produs de Pfizer și partenerul său german BioNTech este primul vaccin contra COVID-19 supus revizuirii FDA.
Se așteaptă ca FDA să acorde autorizația de utilizare de urgență (EUA) sâmbătă, deși din cauza cerințelor legale și birocratice, anunțul s-ar putea decala până duminică sau mai târziu. Guvernul federal este pregătit să lanseze o campanie de vaccinare masivă la începutul săptămânii viitoare, dacă agenția permite utilizarea de urgență a vaccinului.
“Este cu adevărat un moment important. FDA are probabil cea mai mare autoritate în domeniul de autorizare a medicamentelor. Decizia pe care o va lua va atârna mult mai greu decât deciziile din Marea Britanie și Canada. Ne putem aștepta la un deznodământ asemănător și în UE” – Dr. Marius Geantă, președintele Centrului pentru Inovație în Medicină (InoMed).
Consilierii din cadrul FDA au votat joi noapte pentru a recomanda agenției americane acordarea autorizației de utilizare de urgență pentru vaccinul Pfizer-BioNTech. Șaptesprezece membri ai comitetului consultativ pentru vaccinuri și produse biologice conexe au votat în favoarea, patru au votat împotriva iar un membru s-a abținut. Cu rare excepții, FDA urmează sfaturile grupurilor sale consultative.
“Întrebarea nu apare niciodată atunci când știi totul, ci atunci când știi suficient. Cred că știm destul acum pentru a spune că aceasta pare a fi calea noastră de a ieși din această dezordine îngrozitoare – pandemia COVID-19”, a declarat Dr. Paul Offit, directorul Vaccine Education Centre de la Spitalul de Copii din Philadelphia și membru al comitetului, după acordarea votului pozitiv.

Comunicare transparentă din partea FDA către publicul larg
Pe 20 noiembrie, compania Pfizer a înaintat cererea de aprobare în regim de urgență pentru vaccinul BNT162b2 în vederea imunizării active și prevenției COVID-19. Datele oferite de companiile Pfizer și BioNTech au fost analizate în cadrul acestei sesiuni deschise.
“Astăzi vom discuta posibilitatea de a oferi americanilor un vaccin contra COVID-19. Publicul merită o revizuire independentă și comprehensivă a datelor, iar acest lucru a fost făcut în mod permanent de către membrii acestui comitet științific”, au declarat experții în deschiderea ședinței FDA.
Ziua de ieri a fost un moment important pentru că pentru prima dată, o autoritate de reglementare a organizat public un eveniment de o astfel de amploare. A fost un exercițiu de comunicare și de transparență, absolut necesar în acest context, în care publicul trebuie să înțeleagă și să îi fie explicată știința din spatele vaccinului, știința dezvoltării vaccinului și a reglementării vaccinului. Modul acesta de comunicare: deschis, transparent, este un demers foarte potrivit și obligatoriu din partea FDA și se corelează cu ceea ce vrea să facă și EMA, ambele autorități fiind foarte conștiente de starea de spirit de la care se pornește.
Atât FDA, cât și EMA au subliniat faptul că nu se află sub presiune politică și că întreaga comunitate științifică ce formează grupurile de lucru și consultări este concentrată asupra a ceea ce au de făcut, lăsând politicul deoparte în aceste momente. Aceste întâlniri sunt eminamente științifice.
“La sfârșitul lunii octombrie am realizat un sondaj de opinie referitor la sursele de ezitare în vaccinare. O categorie considerabilă de români nu e nici împotriva, nici în favoarea vaccinării, ci este într-o stare ezitantă. Românii mai degrabă s-ar vaccina însă doresc sa aibă date științifice pentru a lua această decizie. Toate persoanele relevante, de specialitate, trebuie să fie implicate în această campanie de vaccinare încă din fazele timpurii”- Prof. Alina Bârgăoanu, expert în comunicare și decan al Facultăţii de Comunicare şi Relaţii Publice, expert în comunicare.
Ce înseamnă autorizația de utilizare de urgență?
Sunt patru criterii esențiale pe care trebuie să le îndeplinească un produs pentru a primi autorizația de utilizare de urgență (EUA):
- agentul patogen să cauzeze o afecțiune amenințătoare de viață;
- produsul să fie eficient în prevenția, diagnosticul și tratamentul unei boli cauzate de SARS-COV-2;
- beneficiile potențiale ale agentului să fie mai importante decât posibilele riscuri;
- să nu existe o alternativă la acest produs pentru managementul bolii.
Sunt două modalități aflate la dispoziție atunci când companiile aplică pentru aprobarea unui tratament sau unui vaccin:
- Emergency Use Authorization, folosită în acest moment;
- Biologic License Application, o variantă mai lungă pentru că modalitatea în care datele sunt verificate este mai greoaie. Așa că, în contextul pandemiei, prima cale a fost cea de urmat.
Autorizația de utilizare de urgență (EUA) este o cale de aprobare rapidă, excepțională. EUA se adresează unor produse medicamentoase necesare, sigure și se adresează unor situații excepționale. Decizia de eliberare autorizației de urgență are loc în urma unei analize risc-beneficiu. Criteriile sunt foarte bine definite în legislația FDA, așa că aceasta nu e echivalentă cu o aprobare finală, care va fi o procedură aparte, pe care o vom vedea pe parcursul anului următor.
De la obținerea autorizației de utilizare de urgență (EUA) la obținerea licenței
Orice vaccin valabil prin EUA trebuie să continue testările pentru a permite obținerea licenței cât de curând posibil. Evaluarea suplimentară, pentru cel puțin 6 luni în general, include studii de follow-up pe termen lung a unui număr substanțial de participanți, pentru a constitui o bază de date despre siguranța produsului.
Dr. William C. Gruber, vicepreședintele diviziei de cercetare și dezvoltare a vaccinurilor în cadrul Pfizer, a anunțat că plănuiesc înaintarea cererii pentru aprobare a medicamentelor biologice (BLA) la începutul anului 2021.
Ieri, 10 decembrie, au fost publicate și rezultatele primului studiu clinic controlat placebo ce a evaluat siguranța și eficacitatea vaccinului BNT162b2 în prevenția COVID-19. Datele au arătat că un regim sub formă de două doze de vaccin BNT162b2 conferă 95% protecție împotriva COVID-19 la persoanele cu vârsta de peste 16 ani. Siguranța la două luni distanță de la administrare a fost similară cu cea a altor vaccinuri virale.
Reprezentanții Pfizer au explicat care este rolul celei de-a doua doze de vaccin. Datele existente până acum susțin faptul că a doua doză (booster) ajută la prelungirea timpului pentru care se menține imunitatea. Momentan nu există suficiente date pentru a analiza rolul unei singure doze de vaccin.
Prioritățile în perioada imediat următoare sunt determinarea eficacității vaccinului în prevenția COVID-19 în rândul a diverse grupuri populaționale, determinarea duratei protecției, comparația cu alte vaccinuri potențial disponibile, precum și stabilirea dacă modificările apărute în genomul viral reprezintă o amenințare asupra eficacității vaccinului.
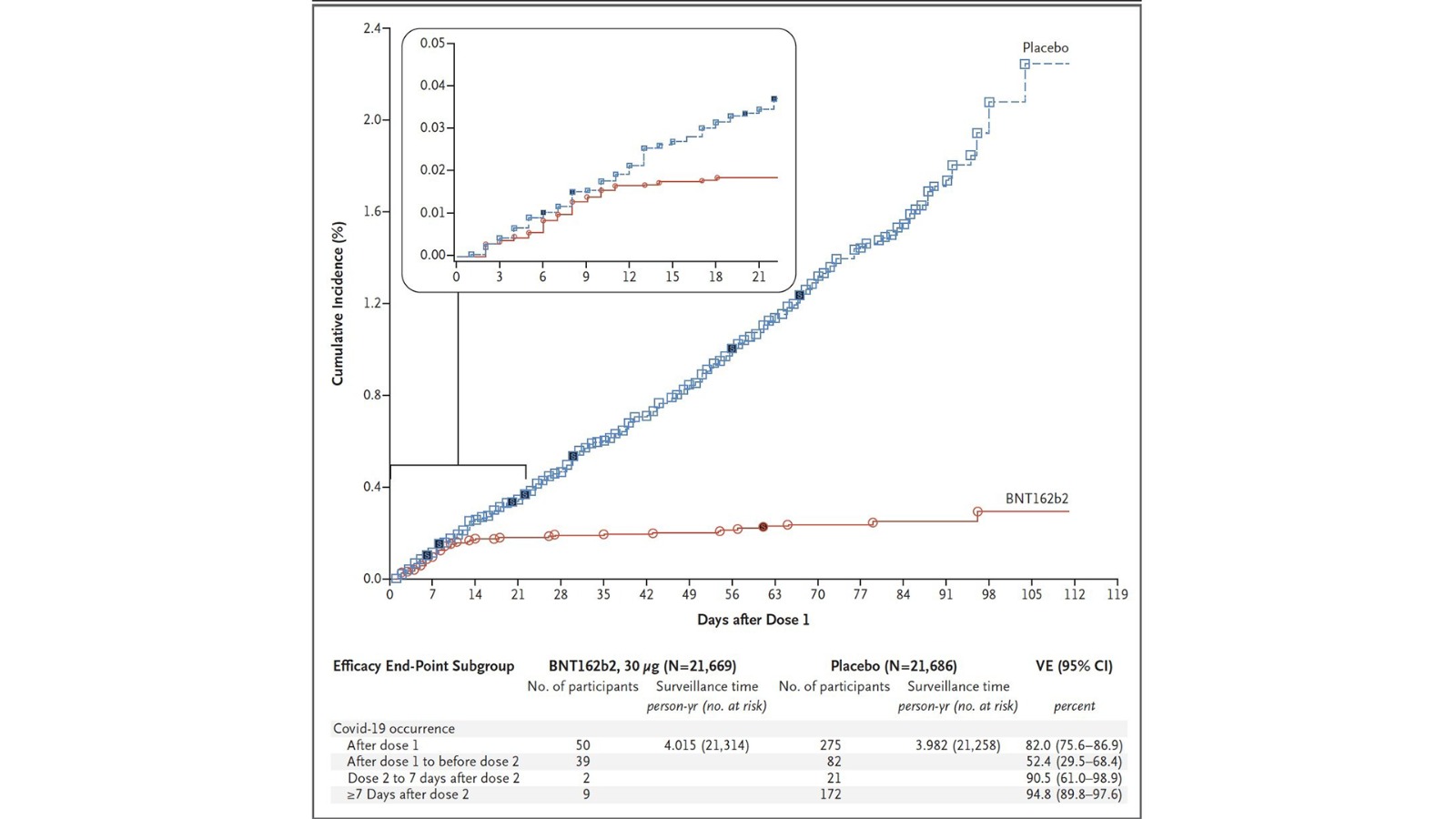
Continuarea cercetării asupra eficacității și siguranței vaccinului
Aspectele de bază în discuțiile FDA au fost cele două direcții: eficacitatea și siguranța. Percepția majorității experților a fost pozitivă, însă reprezentanții societății au fost mai precauți, solicitând o urmărire mai îndelungată. Dincolo de eficacitatea dovedită (95%), rămân multe întrebări.
Reacțiile adverse au fost relativ rare, și de o intensitate ușoară-moderată. Cele mai uzuale reacții adverse nu se corelează cu un risc real, semnificativ pentru pacienți: durere la locul de administrare, cefalee, fatigabilitate, febră, diaree, care au apărut la 1-2% din populația vaccinată.
“Dacă înțelegem principiile ARNm, ne dăm seama că un vaccin bazat pe ARNm este deosebit de sigur. ARNm nu se menține și nu se cantonează la nivelul organismului. În absența revers transcriptazei, deosebit de rară în natură, ARNm nu poate afecta genomul pacientului vaccinat” – Prof. Dr. Robert Ancuceanu, profesor de Botanică Farmaceutică şi Biologie Celulară în cadrul UMF „Carol Davila”, Facultatea de Farmacie.
Însă aceasta este numai forma activă a farmacovigilenței, cea apărută în urma studiilor clinice, care relevă cauzalitatea dintre vaccin și evenimentele adverse, și este cea solicitată de autoritățile de reglementare. Farmacovigilența pasivă va urma în perioada post-marketing și este cea care va ridica posibile semne de întrebare ce vor trebuie verificate prin studii ulterioare.
Prospectul din Marea Britanie vorbește despre precauții în cazul persoanelor cu imunosupresie (unele forme de cancer în funcție de tratament, infecția HIV-SIDA, alergiile). O recomandare separă alergiile severe (istoricul de reacție anafilactică la orice vaccin în trecut reprezintă o contraindicație) de formele ușoare, care nu ar trebui sa reprezinte probleme. Alte precauții sunt reprezentate de tratamentul anticoagulant și infecții severe care asociază febră înaltă (febra moderată, chiar asociată cu o infecție respiratorie ușoară, nu constituie o contraindicație, ci doar o precauție). Medicii, dar și pacienții trebuie să aibă în vedere aceste antecedente personale relevante.
“Din păcate nu avem încă rezultate clare cu privire la efectele vaccinării la bolnavii cronici. Este clar că este o autorizație de urgență și se adresează publicului larg care nu are alte probleme de sanatate. Este ceea ce se discută în ultimele zile: dacă vaccinăm 70% din populație, există șanse să îi protejăm pe ceilalți 30%”, a comentat Rozalina Lăpădatu, Președinte al Asociației Pacienților cu Afecțiuni Autoimune.
Epidemiologii de la CDC au considerat două grupe la risc: copiii cu vârsta cuprinsă între 0-5 ani și adulții de peste 65 de ani. Conform acestora, copiii au șanse la fel de mari de îmbolnăvire precum adulții. În plus, pentru ca vaccinarea să fie eficientă la nivel populațional, e nevoie de o acoperire de cel puțin 60-70% din populație. Acest lucru devine cu atât mai dificil în lipsa unui vaccin cu indicație pediatrică. Este esențială abordarea și acoperirea populației pediatrice.
Informațiile legate de efectul vaccinului în primele cazuri de administrare la copiii cu vârste fragede sunt încurajatoare. Reprezentații Pfizer se așteaptă ca în luna aprilie a anului viitor să înceapă un studiu clinic pentru vaccinarea copiilor cu vârsta cuprinsă între 5-11 ani. Este posibil să fie nevoie de ajustarea dozelor la această populație.
Cele două studii care se desfășoară momentan pentru a dovedi eficiența și siguranța vaccinului includ grupe diferite de vârstă și obiective diferite. Populația a fost extinsă pentru cel de-al doilea studiu pentru participanți cu vârsta mai mare de 12 ani și persoane cu afecțiuni cronice sau imunosupresie. În timp ce primul studiu a dovedit imunogenicitatea vaccinului, cel de-al doilea studiu și-a propus analiza administrării de doze diferite în funcție de categoria de vârstă.
În ceea ce privește administrarea vaccinului la femeile gravide, momentan datele sunt limitate. La sfârșitul lunii sunt așteptate rezultatele studiilor pe animale, care preced de obicei licențierea unui vaccin în ceea ce privește includerea femeilor în EUA. Conform reprezentanților FDA, printre grupele prioritare pentru imunizare prin EUA vor fi femeile cu potențial de sarcină, dar momentan nu există date care să dovedească indicații sau contraindicații pentru femeile care ar putea rămâne însărcinate.
Datele prezentate astăzi sunt limitate în ceea ce privește persoanele care au avut deja infecția COVID-19 înaintea vaccinarii. Din studiu au fost excluși indivizii cu test PCR pozitiv pentru COVID-19 la momentul înrolării în studiu, dar 2-3% din participanții la studiu prezentau anticorpi anti-COVID-19, deci fuseseră infectați în antecedente. Conform reprezentanților Pfizer, datele nu indică faptul că vaccinul ar fi o problemă pentru subgrupul de pacienți infectați în trecut cu SARS-CoV-2.
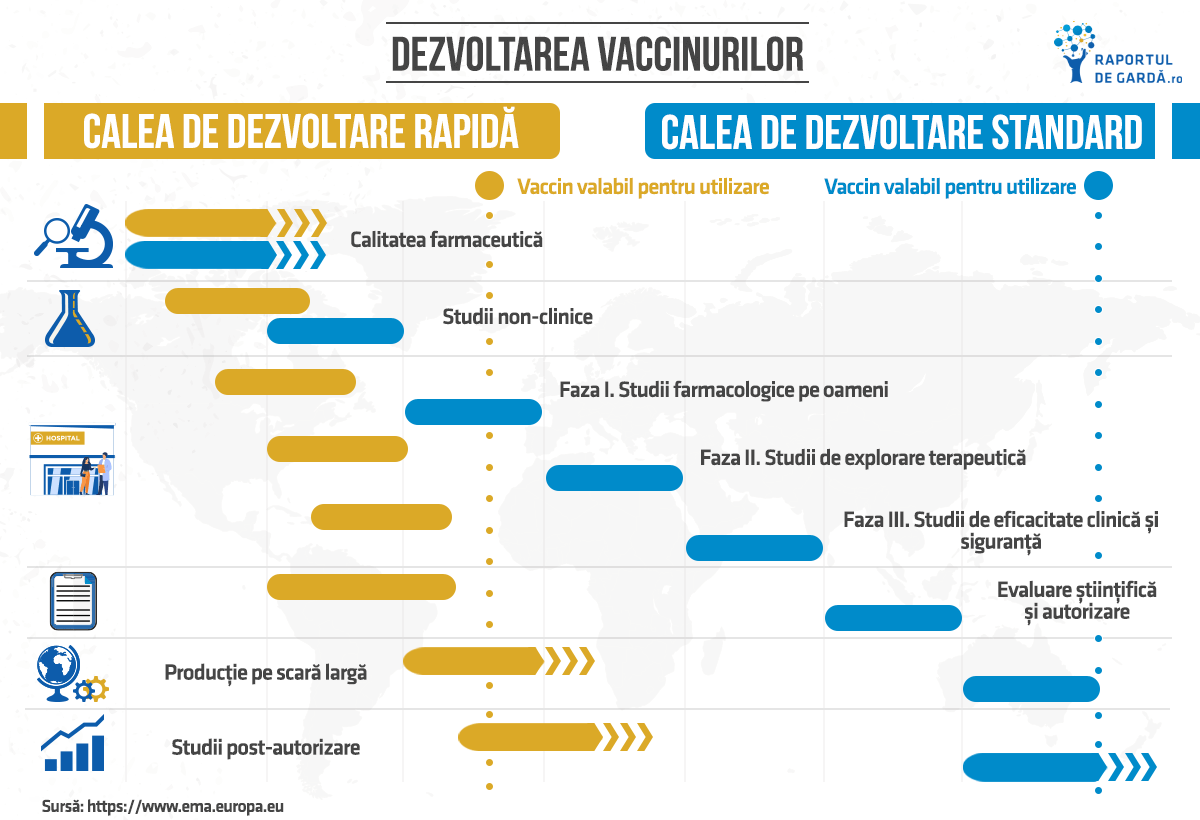
Astăzi, 11 decembrie, urmează decizia EMA pe acest subiect
Administrarea vaccinului unei persoane în afara unui studiu clinic nu se poate realiza fără această autorizație. Pentru România e importantă decizia EMA pentru că prospectul, pe care îl va elabora EMA va fi cel relevant pentru populația din România. Ce se întâmplă până la acel moment sunt doar factori predictivi foarte puternici pentru a stabili indicațiile/contraindicațiile în UE.
“Pe noi ne interesează direct decizia EMA. Ne uităm acum la SUA ca să avem cât mai multe indicii. Datele sunt aceleași, însă perspectiva asupra lor este diferită și va fi interesant să ne uităm la fiecare caz în parte”, a comentat Dr. Marius Geantă.
Prof. Dr. Alexandru Rafila a precizat că din datele pe care le avem până acum, vaccinul produs de Pfizer/BioNTech va fi autorizat pe 25 decembrie, iar pe 27 decembrie, cel produs de Moderna. Apoi vor fi necesare două zile pentru a fi autorizat de Comisia Europeană. Vor exista viteze diferite între țările UE în ceea ce privește accesul la vaccin, unele vor beneficia mai repede dacă vor avea un proces de vaccinare bine pus la punct.
“Fără continuarea măsurilor individuale de protecție, succesul campaniei de vaccinare nu va fi același. Transmiterea trebuie ținută cât mai mult sub control până când acoperirea vaccinală va fi suficient de mare. Eradicarea va fi imposibilă deoarece un virus adaptabil va produce în continuare îmbolnăviri. Un avantaj va fi deprinderea însă unor comportamente dobândite în această perioadă”, a declarat Prof. Dr. Alexandru Rafila, Președintele Societății Române de Microbiologie și membru al Comitetului Executiv al Organizației Mondiale a Sănătății (OMS).
Citește și:
- BREAKING NEWS: Vot pozitiv pentru utilizarea de urgență a vaccinului Pfizer/BioNTech în Statele Unite ale Americii
- Cum se acordă autorizarea condiționată de punere pe piață în Uniunea Europeană pentru vaccinurile împotriva COVID-19?
- Cum funcționează tehnologia ARN mesager folosită în vaccinurile COVID-19?


