#DecodămCancerul. Sute de boli sunt reunite astăzi sub denumirea de cancer. Cum a evoluat înțelegerea asupra cancerului și care este rolul științelor „omice”?
Excluzând accidentele (accidente rutiere, accidente la locul de muncă, intoxicații, etc.), factorii genomici sunt implicați în 9 dintre principalele 10 cauze de mortalitate din Statele Unite ale Americii. Cancerul reprezintă una dintre cele mai mari provocări ale umanității, iar descoperirea bazelor genetice a condus la o nouă înțelegere a fenomenului. S-a considerat că descifrarea genomului uman va reprezenta un pas important în lupta împotriva cancerului, însă a reprezentat mai mult un pas important spre înțelegerea complexității bolii. 8 milioane de oameni mor anual din cauza cancerului la nivel global. Deși supraviețuirea a crescut semnificativ, incidența cancerului se estimează că va crește cu 50% în 2020.
William Howard Taft, președintele SUA din 1910, declara că „în 5 ani cancerul va fi eliminat de pe lista de boli fatale”. Un secol mai târziu înțelegerea cancerului cu siguranță s-a schimbat, însă acesta reprezintă, în continuare, o boala asociata cu o mare provocare pentru pacienți, familii, medici si sistem de sănătate, în ansamblu.
Găsirea tratamentului pentru cancer a fost, de-a lungul timpului, una dintre principalele preocupări ale omenirii și un obiectiv suprem al lumii științifice. De ce nu s-a găsit încă tratamentul pentru cancer? Aceasta este o întrebare care trebuie de fapt reformulată.
- Cancerul nu reprezintă o singură boală, ci reunește sute de boli
Cancerul este un termen general, iar ideea unui tratament universal pentru vindecarea cancerului determină simplificarea unui fenomen extrem de complicat. Descifrarea genomului uman reprezintă un moment istoric și a făcut posibilă identificarea a sute de gene asociate cu riscul de cancer. Într-un anumit tip de tumoră există mai multe tipuri de celule modificate. Înțelegerea cancerului a evoluat de la definirea bolii în funcție de localizarea tumorii până la descrierea modificărilor care apar la nivel de celulă.
- Mecanismele implicate în cancer se modifică în timp
Deși inițial tumorile prezintă același tip de mutație driver, în timp apar noi anomalii. Toate acestea pot fi determinate de tipul de cancer, de alți factori genetici și factori care țin de stilul de viață al pacientului.
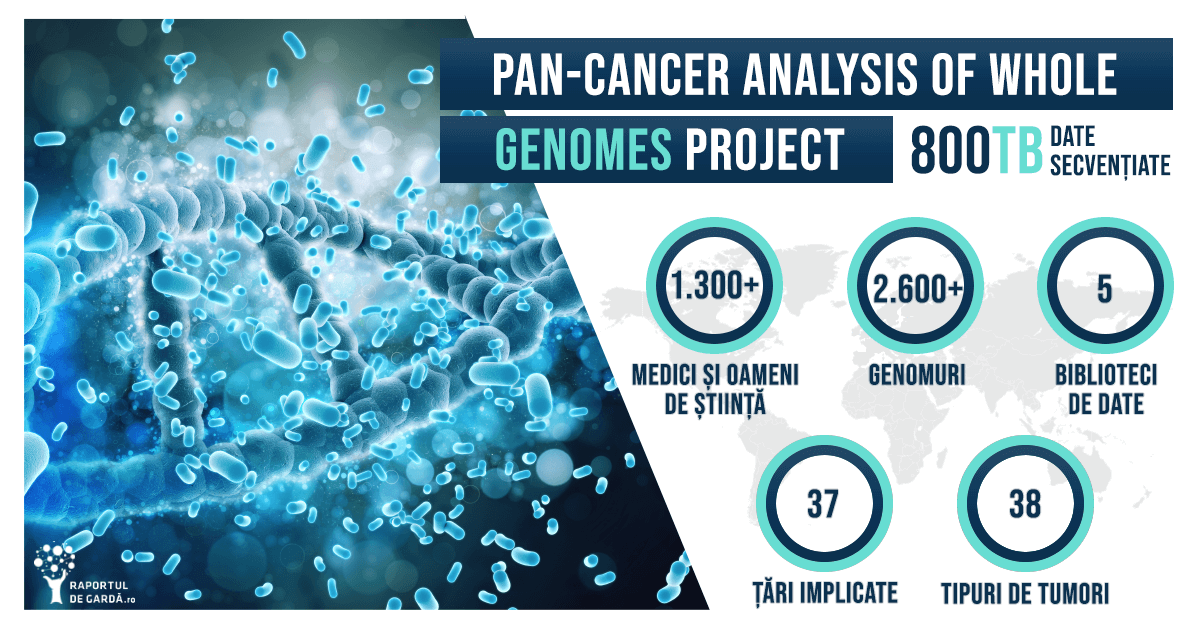
În cadrul Pan Cancer Project, cea mai mare analiză a genomului cancerului realizată vreodată, peste 2.500 de genomuri au fost secvențiate, reprezentând 38 de tipuri de cancere, și s-au cercetat 47 de milioane de modificări genetice asociate acestora. Pentru 30 de tipuri de cancere s-au identificat modificări specifice și momentul din evoluția tumorală când acestea apar. 20% dintre mutații apar cu mult timp înainte de identificarea unui anumit tip de cancer, chiar decenii.
- Nu există un tratament universal pentru cancer
Cancerul pulmonar, de exemplu, este o singură entitate clasificată în mai multe subtipuri histologice. Însă profilul genetic al fiecărui subtip este diferit. Tratamentul este, de asemenea, diferit și poate fi selectat în funcție de anumiți indicatori biologici numiți biomarkeri.
În 2017, FDA a aprobat pembrolizumab, pentru tratamentului cancerelor care prezintă instabilitate microsatelitară. Pentru prima dată tratamentul cancerului s-a făcut pe baza biomarkerilor, nu pe baza localizării în organism. S-a deschis astfel era tratamentelor tumor agnostic. Anul următor, FDA a aprobat larotrectinib, pentru tratamentul cancerelor ce prezintă mutații la nivelul genelor NTRK . Larotrectinib și-a demonstrat eficacitatea în cel puțin 17 tipuri de cancere care prezintă această anomalie genetică.
În ultimii 5 ani, imunoterapiile au devenit piatra de temelie în lupta împotriva cancerelor solide – peste 2.000 de studii clinice sunt în derulare în prezent. O funcție importantă a sistemului imun ține de diferențierea dintre celulele normale din organism și celulele „străine”. Astfel, celulele străine pot fi distruse, iar celulele normale recunoscute. Pentru a se realiza această selecție este necesar ca anumite molecule de pe suprafața celulelor sistemului imun să fie activate sau inactivate pentru a porni un răspuns imun.
La mijlocul anilor ’70, rata de supraviețuire la 5 ani la adulți pentru toate tipurile de cancere era de 50%. Astăzi pentru anumite tipuri de limfom Hodgkin supraviețuirea la 5 ani este de peste 90%. În anumite forme timpurii de cancer de sân sau cancer de prostată ratele ajung la peste 95%. Ratele de mortalitate prin cancer au scăzut cu aproape 30%, de la începutul anilor ’90 până în 2017, în Statele Unite ale Americii. Din 2016 în 2017, rata mortalității a scăzut cu 2,2%, un record în statisticile naționale de după 1930. Cea mai importantă contribuție o are progresul în controlul cancerului pulmonar.
Astăzi, secvențierea genomului costă de 100.000 ori mai puțin ca în trecut. Tehnologiile de nouă generație pot citi secvențe de 50.000 de ori mai rapid. Secvențierea prin metoda Sanger a fost înlocuită cu metode performante care permit scăderea timpului și costurilor necesare descifrării întregului genom uman. Înainte de asta căutarea informațiilor despre structură sau numărul de copii necesita integrarea datelor din mai multe platforme.
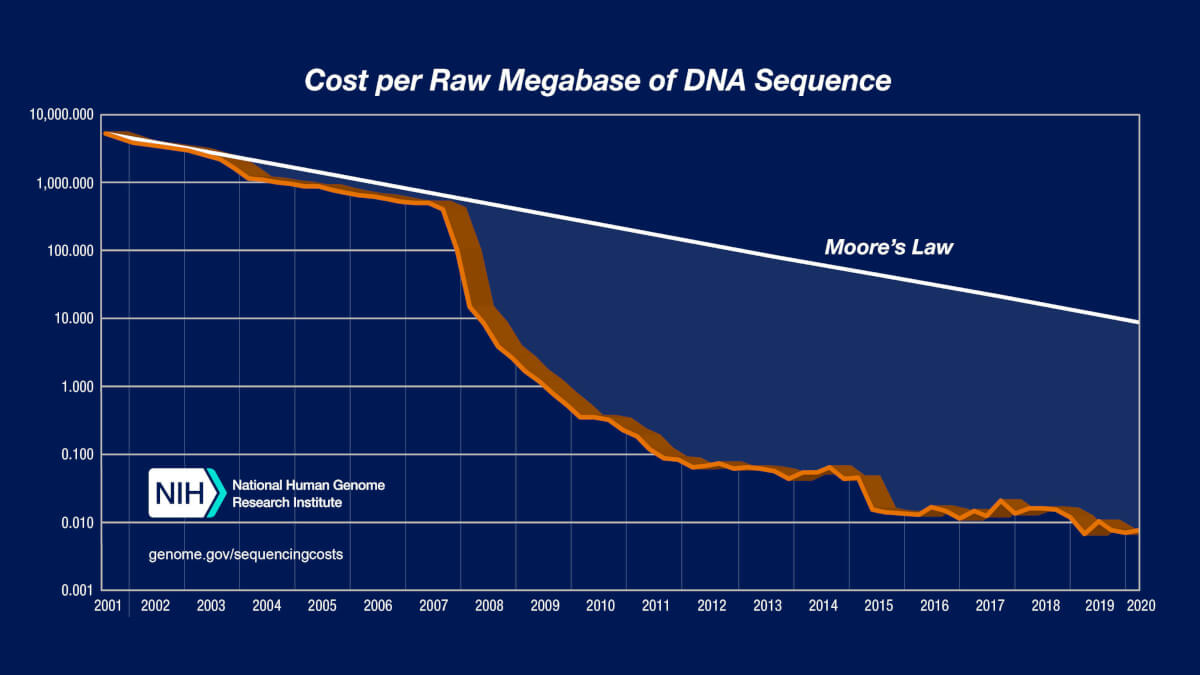
A durat 13 ani pentru a se completa secvența genomul uman, însă astăzi acesta poate fi secvențiat și într-o zi. Tehnologia nu mai reprezintă o barieră, iar atenția se îndreaptă asupra informației care trebuie analizată.
Cum a evoluat înțelegerea cancerului din perspectivă genetică
De-a lungul timpului au fost recunoscute câteva caracteristici ale neoplasmelor care includ angiogeneza, proliferarea celulară, alterarea apoptozei, invazia țesuturilor învecinate și apariția metastazelor. Capacitatea unei populații de celule de a prolifera depinde de rata de diviziune și cea de moarte celulară. Ambele sunt însă sub control genetic.
Cancerele sporadice reprezintă majoritatea cancerelor care apar la om și rezultă dintr-o acumulare de modificări genetice și epigenetice care afectează atât genele care codifică proteine cât și regiunile necodante. Primele tentative de a identifica genele care codifică proteine s-au lovit de limitările care țineau de tehnologia disponibilă la momentul respectiv, dar și de complexitatea genomului tumoral.
În 1914 a fost emisă ipoteza conform căreia modificările numerice ale cromozomilor unei celule pot determina un proces neoplazic. 50 de ani mai târziu este identificată prima anomalie cromozomială specifică în genomul tumoral – cromozomul Philadephia la pacienții cu leucemie mieloidă cronică.
În anii ’70 s-a propus un model al carcinogenezei care urmează anumite etape evolutive. Există un eveniment inițiator prin care o celulă normală devine neoplazică, ulterior cancerul progresează și apare instabilitatea genomică – se acumulează modificări genetice și sunt selectate populații de celule care au un avantaj de creștere. Înțelegerea cancerului din perspectivă genetică a început să ia amploare. La mijlocul anilor ’80 erau identificate deja două tipuri de gene asociate cancerului – oncogenele și genele supresoare tumorale. În anii următori, identificarea genelor a fost dificilă pentru că lipsea o caracterizare a genomului uman normal. Aceasta a fost posibilă abia după 2003, când a fost publicată forma finală a genomului uman.
S-a descoperit astfel complexitatea genomului uman, iar proiectele ulterioare au identificat heterogenitatea cancerelor și faptul că fiecare pacient are nevoie de terapie personalizată. Primele terapii țintite s-au adresat unor neoplasme hematologice. De exemplu, imatinib, o terapie țintită a crescut semnificativ supraviețuirea în leucemia mieloidă cronică. Trastuzumab a demonstrat, ulterior, eficacitatea în cancerul de sân HER2 pozitiv.
Genomul cancerului
În 1979 era descoperită gena p53, cunoscută și sub numele de „gardianul genomului” , o genă supresoare tumorală cu rol în menținerea stabilității genomului. Studierea acesteia a generat peste 65.000 de lucrări științifice și investiții estimate la 6,5 miliarde de dolari. Mai mult de 75 de milioane de oameni sunt diagnosticați cu neoplasme care prezintă această mutație. Totuși, până în prezent nu există niciun tratament aprobat de FDA.
Identificarea câte unei gene cu un anumit rol în carcinogeneză nu oferea informații asupra a ceea ce se întâmplă de fapt într-un proces biologic atât de complicat.
Celulele canceroase sunt selectate să supraviețuiască. Acest aspect nu este întâmplător, multe mutații diferite converg spre același fenotip. Asta înseamnă că multe tipuri de cancere pot fi la fel la nivel macroscopic, dar diferite din punct de vedere genetic. Ce determină manifestarea acestor mutații prin creșterea celulară necontrolată? Care sunt mutațiile-cheie care determină apariția celor mai frecvente tipuri de cancere? Care sunt mutațiile care apar primele în evoluția cancerului?
Pentru înțelegerea semnificației genelor asociate cancerului a fost necesară o perspectivă mai amplă, la nivelul întregului genom. Dincolo de activitatea genelor individuale, interacțiunile dintre acestea, interacțiunile dintre gene și proteine sau alte molecule permit înțelegerea unor detalii esențiale ale biologiei neoplasmelor.
Pe 5 februarie, 23 de articole științifice au fost publicate în Nature și în jurnale afiliate, reunind cea mai importantă analiză asupra mecanismelor moleculare implicate în cancer realizată vreodată – Pan Cancer Project. Cercetările au demonstrat că există un număr limitat de mutații driver, însă combinațiile de mecanisme prin care interacționează sunt de ordinul zecilor de mii. 20% dintre mutații apar cu mult timp înainte de identificarea unui anumit tip de cancer, chiar decenii. Jumătate dintre modificări apar la nivelul a 9 gene specifice. Pentru 30 de tipuri de cancere s-au identificat modificări specifice și momentul din evoluția tumorală când acestea apar. De exemplu, anumite mutații apar precoce în cazul cancerului ovarian și în cazul glioblastomului.
Înțelegerea biologiei cancerului la intersecția dintre științele omice
Tumorile prezintă de obicei multiple modificări, atât în ceea ce privește mutațiile de la nivelul ADN-ul, cât și în ceea ce privește expresia genică. Țintirea unui număr redus de anomalii genetice poate fi însoțită de un răspuns nesatisfăcător, deoarece există și alte mecanisme care promovează creșterea tumorală.
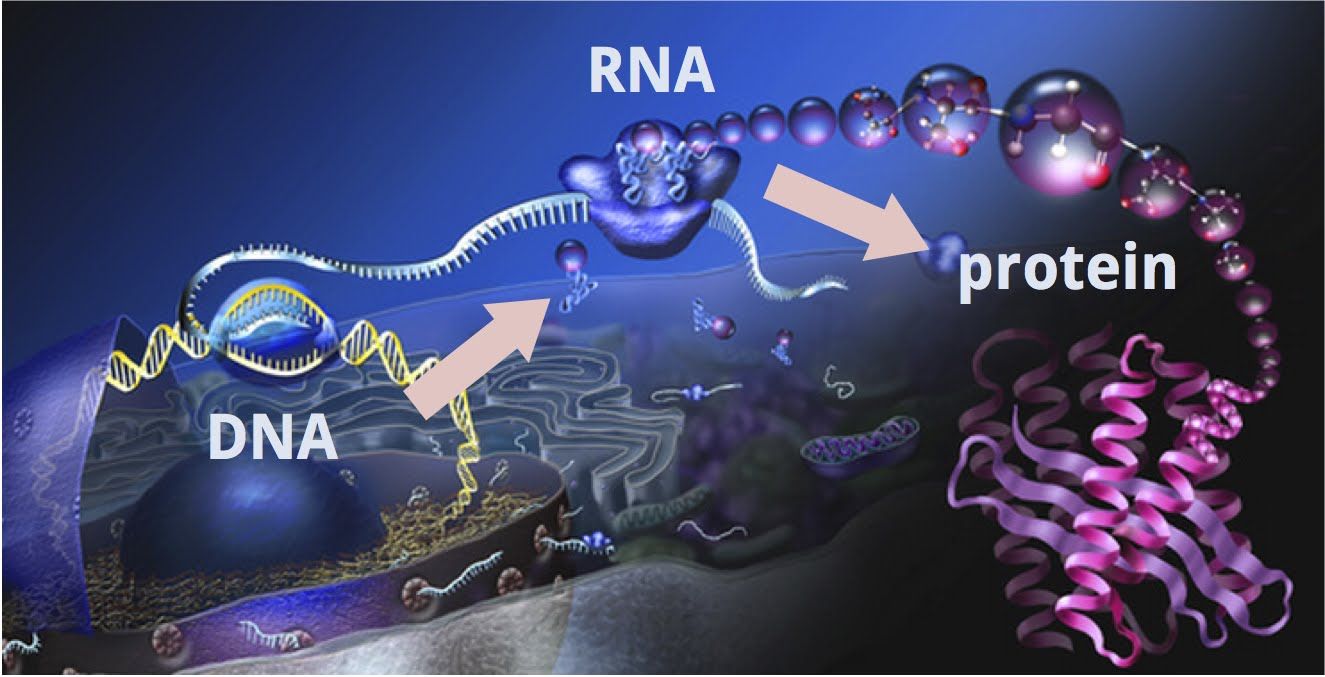
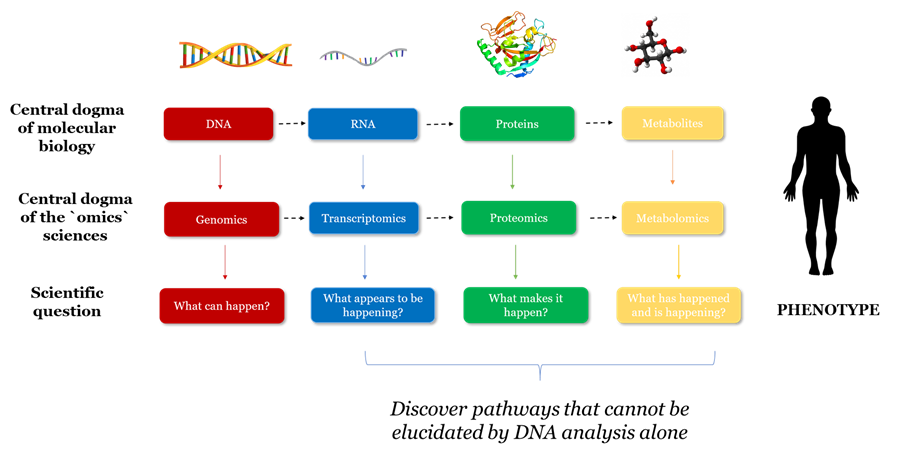
Spre deosebire de genom, care cuprinde setul fix de gene, transcriptomul variază în funcție de mai mulți factori. Informația genetică este codificată în secvența ADN, iar transcripția reprezintă primul pas prin care se realizează expresia ei. Conform dogmei centrale în biologia moleculară, din ADN se obține ARN, iar ARN-ul poartă mesajul necesar producției de proteine. Analiza transcriptelor ARN permite o evaluare profundă a mecanismelor implicate în carcinogeneză și oferă date pe care secvențierea ADN nu le poate surprinde.
Proteomica, studierea structurii și funcției produșilor codificați de gene, proteinele, reprezintă cel mai accesibil domeniu al științelor omice. Pe lângă faptul că ne permite înțelegerea fenotipului cancerului, proteomica are avantajul de a reprezenta un nivel la care se poate acționa direct. Multe proteine sunt deja biomarkeri în cancer sau sunt evaluate drept ținte terapeutice. În combinație cu genomica, aceasta poate caracteriza componentele proteice la nivel celular sau tisular, modul în care sunt exprimate proteinele, relația dintre structură și funcție în organismul sănătos, sau în context patologic. Dintr-o genă se pot obține mai multe molecule de ARN care poartă mesaje diferite. Mai mult decât atât, există peste 200 de modificări posttranslaționale care pot apărea la nivelul proteinelor. Astfel, dintr-o singură genă se pot obține multiple proteine. În cursul transformării neoplazice a unei celule pot apărea numeroase tipuri de modificări care alterează funcția celulară și pot fi cuantificate.
Metabolismul celular este modificat în cancer, celulele necesită resurse pentru a susține proliferarea necontrolată. Reprogramarea metabolică este cauzată de factori multipli, de la anomalii genomice până la alterarea micromediului tumoral. Metabolomica este un domeniu cu un potențial enorm de a creștere „rezoluția” asupra mecanismelor implicate în apariția și progresia cancerului.
Metabolomica e considerată cea mai „recentă” dintre științele omice și este și cea mai apropiată de fenotipul pacientului. Aceasta studiază toți metaboliții produși de organism, care pot deveni indicatori ai unor procese patologice, cum este și cancerul. Rolul metabolomicii în oncologie abia începe să fie explorat cu potențial important în descoperirea de biomarkeri și ținte terapeutice. Dacă transcriptomica și genomica reprezintă o matrice, arată modul în care organismul poate funcționa, iar proteomica modul în care aceste instrucțiuni sunt realizate, metabolomica măsoară ceea ce se întâmplă în organism la un moment dat. Human Metabolome Database reprezintă o resursă comprehensivă, care reunește în jur de 7.900 de metaboliți.
În celulele cu rată mare de diviziune, cum sunt cele neoplazice, anumite căi biochimice sunt amplificate sau reduse. Apar modificări în metabolismul aminoacizilor, acizilor grași, modificări ale glicolizei, etc. Prin boli metabolice sunt desemnate mai ales boli endocrine cum este diabetul. Acestea afectează însă o singură cale majoră implicată în metabolism de cele mai multe ori. Cancerul poate altera numeroase căi metabolice. Un metabolism afectat se reflectă atât în fluide cât și în țesuturi, atât la nivel de tumoră cât și la nivel de răspuns sistemic.
Anul trecut, Premiul Nobel pentru Fiziologie și Medicină a fost acordat pentru elucidarea unuia dintre cele mai importante mecanisme fiziologice ale organismului: „modul în care celulele detectează și răspund la nivelul de oxigen disponibil”. Capacitatea celulelor de a detecta variațiile oxigenului și drept consecință să modifice expresia genică este esențială pentru supraviețuire. În caz de hipoxie, celulele își adaptează metabolismul prin modificarea expresiei genice.
În cazul cancerului, celulele maligne se folosesc de mecanismele adaptative pentru a forma noi vase de sânge și a-și asigura aportul de oxigen necesar pentru a crește. Blocarea acestui fenomen în celulele tumorale poate reprezenta o strategie pentru dezvoltarea de noi terapii antineoplazice. Conform comitetului Nobel, eforturile sunt direcționate în viitor asupra descoperirii de tratamente care activează sau blochează căile prin care celula detectează variațiile oxigenului.
Factorii modificabili implicați în apariția cancerului
În 1930, cancerul începea să fie recunoscut drept o problemă de sănătate publică și se considera că multe forme ar putea fi prevenite dacă societatea este informată. 90 de ani mai târziu, în percepția publică, în ciuda dovezilor științifice, cancerul este determinat mai ales de factori pe care oamenii nu îi pot controla. Un studiu realizat de American Institute for Cancer Research, asupra gradului de informare asupra factorilor de risc implicați în cancer, arăta că mai puțin de 50% dintre americani știau că alcoolul, sedentarismul, consumul de carne procesată sunt factori asociați cu dezvoltarea anumitor tipuri de cancer. Energia nucleară era considerată a 8-a cauză de cancer, în schimb obezitatea era considerată a se afla doar pe locul 16. Din contră, obezitatea va deveni în curând principalul factor de risc evitabil implicat în apariția cancerului.
40% dintre cazurile de cancer din țările cu venituri mari sunt cauzate de factori care țin de stilul de viață, consumul de tutun reprezentând jumătate din acest procent. Rolul fumatului a fost demonstrat în apariția cancerului pulmonar și apoi în alte 17 tipuri de cancere. Introducerea vaccinării pentru hepatita B cu rol în prevenția cancerului hepatic, introducerea vaccinării împotriva HPV în cancerul de col uterin sunt măsuri care au condus la scăderea semnificativă a incidenței unor cancere determinate de factori infecțioși.
Rolul genomicii în prevenția primară și secundară a cancerului a fost mai puțin studiat, deși probabil aceasta o să aibă cel mai mare impact pe termen lung.

Citește și:
- Raport IHE. Incidența cancerului s-a dublat în ultimii 25 de ani în UE, însă mortalitatea a scăzut la persoanele sub 65 de ani. Care este impactul bolii în Europa?
- Situația controlului cancerului în Europa de Est și Centrală- obstacole și posibile soluții

