Enfortumab vedotin-ejfv, aprobat de FDA în regim accelerat pentru tratamentul adulților cu cancer urotelial avansat
Enfortumab vedotin-ejfv (Padcev) este primul anticorp conjugat îndreptat împotriva nectinei-4, care a primit aprobarea de comercializare din partea FDA (Administrația SUA pentru Alimente și Medicamente) pentru tratamentul adulților cu cancer urotelial, avansat local sau metastatic, care au primit anterior tratament neoadjuvant sau adjuvant cu inhibitori PD-L1 și chimioterapie pe bază de platină. Această aprobare a fost acordată prin mecanismul de autorizare accelerată al FDA, pentru terapiile cu potențial beneficiu clinic care se adresează unei nevoi medicale fără soluție existentă.
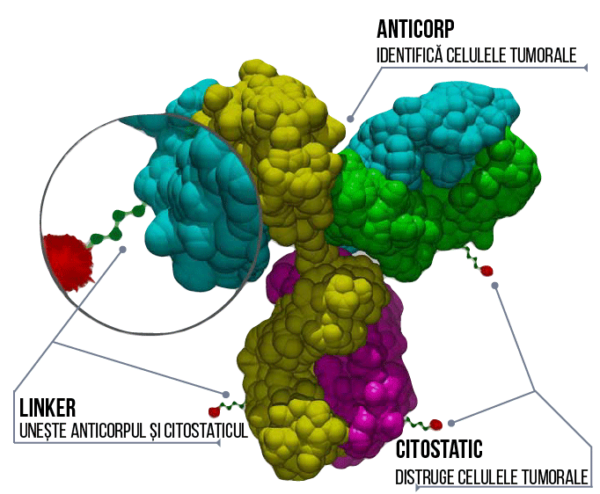
„Anticorpii conjugați reprezintă o unealtă strategică în tratamentul țintit al cancerului. Acești conjugați combină abilitatea anticorpilor monoclonali de a ținti receptori specifici de pe celulele canceroase cu efectul antitumoral al citostaticelor. [Enfortumab vedotin-ejfv] este un anticorp monoclonal anti Nectin-4, o proteină exprimată pe suprafața celulelor din cancerul de vezică urinară, și chimioterapicul monometil auristatin E”- Dr.Richard Pazdur, director FDA Oncology Center of Excellence și director interimar Office of Oncologic Diseases, FDA Center for Drug Evaluation and Research.
Studiul EV-201
Enfortumab vedotin-ejfv a primit aprobarea pe baza rezultatelor studiului monocentric, cu un singur braț, EV-201. Acesta a înrolat 125 de pacienți cu cancer urotelial avansat local sau metastatic, care au primit anterior tratament neoadjuvant sau adjuvant cu inhibitori PD-1 sau PD-L1 și chimioterapice bazate pe platină. Padcev a fost administrat cu o doză de 1,25 mg/kgc în ziua 1,8, și 15, a unui ciclu de 28 de zile, până la progresia bolii sau toxicitate inacceptabilă.
Rata de răspuns obiectiv a fost de 44% (12% rată de răspuns complet și 32% rată de răspuns parțial). Durata mediană de răspuns a fost de 7,6 luni.
Cele mai frecvente reacții adverse au inclus fatigabilitatea, neuropatii periferice, scăderea apetitului, rash, alopecie, greață, disgeuzie (modificări ale senzațiilor gustative), diaree, ochi uscat, prurit și piele uscată. Indiferent de statutul diabetic preexistent, au fost înregistrate come ceto-acidozice și decese la pacienți tratați cu enfortumab vedotin-ejfv. De aceea, se recomandă monitorizarea atentă a glicemiei la paciențiii cu risc pentru diabet sau hiperglicemie.
Enfortumab vedotin-ejfv a primit din partea FDA statut prioritar (Priority Review), de medicament inovator (Breakthrough Therapy) și a intrat în procedura accelerată de aprobare
Citește și:
- FDA aprobă prima terapie țintită pentru cancerul de vezică urinară metastazat
- #SABCS2019. Trastuzumab deruxtecan crește ratele de răspuns în cancerul mamar HER2-pozitiv, avansat, la pacientele care au primit anterior multiple linii terapeutice
- #ASH19. CAR-NK, un nou tip de terapie celulară, care ar putea fi produsă în masă și direct administrată pacientului, eficientă în cancerele hematologice cu celule B

