Hemlibra, aproape de aprobare în Europa: primul tratament pentru hemofilia A cu inhibitori dezvoltat în ultimele două decenii
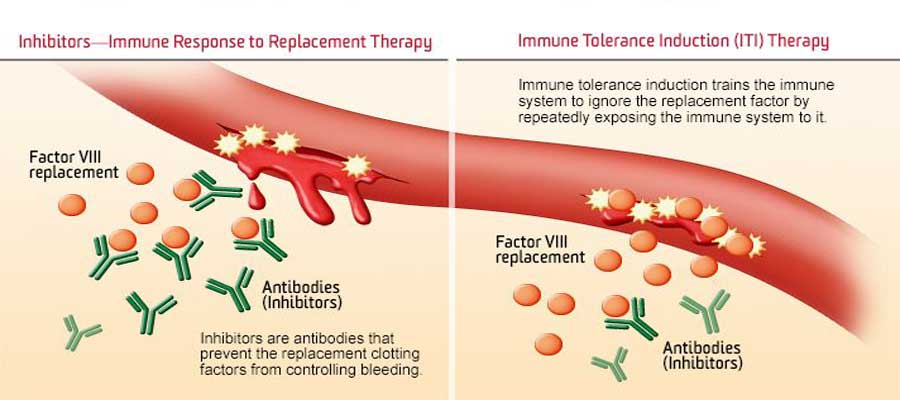
Una dintre marile provocări ale tratamentului hemofiliei A este dezvoltarea anticorpilor împotriva factorului VIII, complicație care apare la aproximativ o treime dintre pacienți.
Emicizumab-kxwh (Hemlibra), un anticorp monoclonal cu statut de medicament inovator, care se administrează subcutanat, o dată pe săptămână, depășeste multe dintre dezvantajele terapiei profilactice intravenoase de substituție cu factor VIII. Pe baza studiilor de fază III – HEAVEN 1 și 2, Comitetul pentru Produse Medicamentoase de Uz Uman (CHMP) din cadrul Agenției Europene a Medicamentului a emis o opinie pozitivă pentru Hemlibra pentru pacienții cu hemofilie A care au dezvoltat inhibitori.
Pornind de la acest aviz favorabil, se așteaptă ca în curând Comisia Europeană să emită decizia de aprobare pentru punerea pe piață.
„Această opinie pozitivă din partea CHMP reprezintă un pas semnificativ înainte pentru a aduce noul tratament pacienților cu hemofilie din Europa. ” – Sandra Horning, Chief Medical Officer, Roche
Principalele date din studii:
- profilaxia cu Hemlibra a indicat o reducere importantă a sângerărilor, de 87% comparativ cu pacienții care nu au primit medicamentul
- la cei tratați cu Hemlibra s-a observat scăderea sângerărilor cu 79% comparativ cu profilaxia cu un agent de bypass – BPA (bypassing agent)
- pentru copiii cu vârste sub 12 ani s-a demonstrată că profilaxia cu Hemlibra nu au înregistrat nici o sângerare care să necesite tratament
- pe o analiză care a inclus 13 copii, profilaxia cu Hemlibra a determinat o reducere cu 99% a ratei sângerărilor față de cei tratați anterior cu BPA
- Hemlibra a fost recomandat pentru toate grupele de vârstă
Inhibitorii sunt anticorpi ce apar ca răspuns la administrarea factorului VIII la una din trei persoane cu hemofilie A severă, ceea ce presupune un risc crescut de sângerări amenințătoare de viață sau sângerări repetate, care pot provoca afectare articulară pe termen lung.
Emicizumab este un tratament profilactic diferit pentru hemofilie, fiind o proteină artificială care mimează funcția factorului VIII al coagulării. Acesta este primul medicament din ultimii 20 de ani, aprobat deja de FDA, care s-a dovedit a fi eficient în prevenirea și reducerea frecvenței episoadelor de sângerare în cazul pacienților cu hemofilia A.
O complicație a administrării factorului VIII este dezvoltarea anticorpilor care scad eficacitatea tratamentului. Emicizumab are o structură diferită, ceea ce înseamnă că inhibitorii nu se dezvoltă, însă funcția substanței se păstrează.
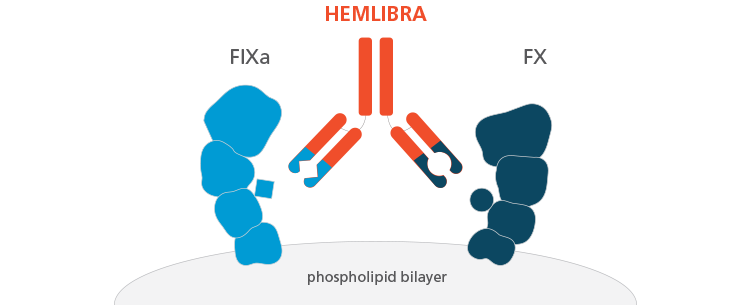
Hemlibra reduce semnificativ frecvența sângerărilor comparativ cu medicamentele disponibile în prezent, iar modul de administrare – o injecție subcutanată pe săptămână – înseamnă o ameliorare a calității vieții, în special pentru copiii cu hemofilie A și pentru familiile lor. Hemlibra a fost recomandat pentru toate grupele de vârstă.
Cererea de autorizație de punere pe piață pentru Hemlibra este evaluată printr-o procedură accelerată, având statut de inovație terapeutică și medicament de mare interes pentru sănătatea publică. Recomandarea se bazează pe studile HEAVEN, prezentate în decembrie 2017 în cadrul Întâlnirii Anuale a Societății Americane de Hematologie.
Ce spun studiile?
Adulți și adolescenți cu hemofilie A cu inhibitori au fost înrolați în studiul HEAVEN 1. Obiectivul principal a fost reducerea ratei de sângerare după 24 de săptămâni de tratament. Profilaxia cu Hemlibra a indicat o reducere importantă a sângerărilor, cu 87% comparativ cu pacienții fără profilaxie. De asemenea, la cei tratați cu Hemlibra s-a observat scăderea sângerărilor cu 79% comparativ cu profilaxia cu un agent de tip bypass – BPA (bypassing agent).
În cazul copiilor cu vârste sub 12 ani, cei care au primit profilaxia cu Hemlibra nu au înregistrat nicio sângerare care să necesite tratament. Pe o analiză care a inclus 13 copii, profilaxia cu Hemlibra a determinat o reducere cu 99% a ratei sângerărilor față de cei tratați anterior cu BPA.
Cele mai frecvente reacții adverse (aproximativ 10% dintre pacienții care au participat la aceste studii clinice) au fost reacțiile locale, la locul injectării, și cefaleea. S-au înregistrat 3 cazuri de microangiopatie trombotică și două cazuri de evenimente trombotice severe la cei care au primit un BPA timp de mai mult de 24 de ore, în timpul profilaxiei cu Hemlibra.
Hemlibra a fost aprobat de FDA pe 16 noiembrie 2017 pentru copiii și adulții cu hemofilie A cu inhibitori, ca terapie profilactică pentru a reduce sau preveni episoadele de sângerări. Hemlibra este studiat în cadrul unui program extins ce cuprinde, pe lângă HEAVEN 1 și 2, două alte studii de fază III – HEAVEN 3 și HEAVEN 4.
Conform rezultatelor din HEAVEN 3, un control bun al hemoragiilor s-a obținut și în cazul adulților și adolescenților cu hemofilie A fără inhibitori la care s-a administrat profilaxie cu Hemlibra la o săptămână sau două, comparativ cu cei care nu au primit profilaxie.
Rezultatele preliminare din HEAVEN 4 au indicat reducerea rate sângerărilor și la pacienții de peste 12 ani tratați cu Hemlibra o dată la patru săptămâni.
Articole similare
- BREAKING NEWS. Vindecarea hemofiliei A și B prin terapii genice este mai aproape de a deveni realitate
- INTERVIU: Dr. Johannes Rischweski – Rolul farmacocineticii în personalizarea tratamentului hemofiliei
- Pfizer lansează două tehnologii inovatoare pentru pacienții cu hemofilie – jocul video Hemocraft și dispozitivul HemMobile Striiv Wearable

