Sacituzumab govitecan, aprobat de FDA pentru tratamentul cancerului de sân triplu negativ metastatic
Conjugatul anticorp-medicament (ADC) sacituzumab govitecan (Trodelvy) a primit aprobare din partea FDA pentru tratamentul pacienților cu diagnostic de cancer de sân metastatic triplu negativ (TNBC) cu recădere sau boală refractară după tratament anterior cu cel puțin 2 linii terapeutice pentru boală metastatică.
Aprobarea vine ca urmare a rezultatelor unui studiu de fază 1/2, în cadrul căruia s-a observat un răspuns obiectiv durabil la pacienții tratați anterior pentru TNBC metastatic.
Dezvoltatorul sacovitumab govitecan, Immunomedics, a anunțat recent că studiul de confirmare, faza III a studiului ASCENT, care explorează sacituzumab govitecan la pacienții cu TNBC metastatic, a fost oprită datorită „probelor convingătoare privind eficacitatatea”.

„Aprobarea Trodelvy, va oferi clinicienilor o nouă unealtă în tratamentul pacienților cu această afecțiune. În studiul nostru, Trodelvy a demonstrat răspunsuri clinice semnificative la pacienții cu TNCB dificil de tratat și schimbă situația din punct de vedere al rezultatelor pentru pacienții cu cancer de sân metastatic” – dr. Aditya Bardia, principalul investigator al studiului de fază 2, de la Massachusetts General Hospital Cancer Center și Harvard Medical School.
Despre studiu
Studiul de fază 1/2 a inclus 108 pacienți cu TNBC cu o vârstă medie de 55 de ani (între 33 și 80 de ani), dintre care 80% au prezentat metastaze viscerale.
Statusul de performanță ECOG a fost 0 pentru 30% dintre cazuri și 1 pentru restul de 70%, iar timpul mediu de la diagnostic până la instituirea tratamentului în cadrul studiului a fost de 1,5 ani.
Datele imunohistochimice au arătat că 57 de pacienți au avut expresie moderată sau puternică a TROP-2 și doar 5 dintre pacienți au avut acest marker absent sau slab.
Numărul mediu de regimuri terapeutice anterioare a fost de 3, (între 2 și 10). Cele mai comune terapii administrate anterior au fost taxanii (98%), antraciclinele (86%), ciclofosfamida (85%) și derivații de platină (75%). Aproximativ 16% dintre pacienți au primit anterior tratament cu inhibitori ai punctelor de control imun.
Media supraviețuirii fără progresie a bolii (PFS) a fost de 5,5 luni și cea a supraviețuirii generale de 13 luni. Rata de supraviețuire la 6 luni de 78,5% și la 12 luni de 51,3%. Rata de supraviețuirea fără progresie a bolii (FPS) la 6 luni a fost puțin peste 40% și aproximativ 15% la 12 luni.
Efectele adverse de grad 3/4 au apărut în 85% din cazuri și efecte severe la 35% dintre pacienți. Doar 3 pacienți au întrerupt tratementul din cauze efectelor adverse.
Cele mai importante efecte adverse au fost cele mielotoxice (neutropenie, anemie).
„Aceasta aprobare scoate în evidență potențialul ADC și întărește premisa că antigenul Trop-2 prezent în mai multe tipuri de cancere solide este o țintă importantă de tratament. Ne-am angajat să extindem utilizarea potențială a Trodelvy în alte tipuri de cancer care exprimă Trop-2”, a declarat Dr. Loretta M. Itri, director medical principal al Immunomedics.
Despre cancerul de sân triplu negativ
Cancerul de sân triplu negativ (TNBC) este caracterizat de lipsa expresiei receptorilor pentru estrogen, progesteron și HER2 (human epidermal growth factor receptor 2). TNBC reprezintă 15% din cazurile de cancer de sân invazive și este asociat cu un prognostic prost și un comportament agresiv al tumorii.
Chimioterapia standard este asociată cu rate de răspuns slabe și supraviețuire fără progresie a bolii de durată scurtă.
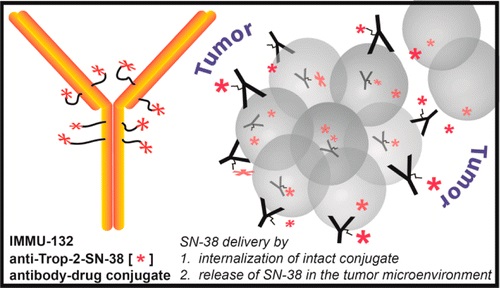
Sacituzumab govitecan este un conjugat anticorp-medicament, adică o combinație între un anticorp monoclonal umanizat care țintește TROP-2 (human trophoblast cell-surface antigen 2) și SN-38, metabolit activ al irinotecanului. Sacituzumab govitecan-permite “livrarea “ unor concentrații mari de SN-38 la nivel tumoral prin atașarea de un anticorp umanizat IgG TROP-2, o glicoproteină de suprafață care este exprimată în peste 90% din cazurile de TNBC.
pubs.acs.org/
Citește și:
- FAQ Cancerul de sân
- #ASCO19. Rezultate pozitive ale imunoterapiei și terapiei țintite în cancerul mamar
- Raport IHE. Tratamentul personalizat al cancerului: cum au evoluat țintele terapeutice în oncologie în ultimele două decenii?

