Raport IHE. Tratamentul personalizat al cancerului: cum au evoluat țintele terapeutice în oncologie în ultimele două decenii?
Tratamentul cancerului a evoluat rapid în ultimul deceniu, către o abordare personalizată. Tehnologiile moderne, precum NGS, permit astăzi o caracterizare moleculară ce conturează un tablou unic pentru fiecare pacient. Pe baza modificărilor genomice tumorale au fost descoperite ținte noi de tratament, unele dintre ele putând fi acționate în mod direct prin terapii personalizate. Testările genomice tumorale au evoluat în timp, de la câțiva biomarkeri, până la paneluri extinse – ce permit analiza tuturor mutațiilor asupra cărora se poate acționa prin terapii țintite, și mai mult, biomarkeri ce permit includerea pacienților în studii clinice pentru tratamente încă neaprobate.
Raportul „Comparator Report on Cancer in Europe 2019” realizat de către IHE (The Swedish Institute for Health Economics) prezintă o imagine de ansamblu a cancerului la nivel european.
În ceea ce privește țintele terapeutice în cancer, raportul arată că cercetările în acest domeniu au condus la aprobarea a numeroase medicamente în ultimii ani și, mai mult decât atât, există numeroase alte molecule încă în studii clinice sau preclinice, astfel încât ne putem aștepta la modificări complexe ale standardelor terapeutice în cancer în viitorul apropiat.
Care este situația actuală a țintelor terapeutice și care sunt ariile de interes în cercetare?
Genomul uman codifică peste 500 proteinkinaze, iar diferite mutații ale acestora sunt implicate în etape importante ale carcinogenezei. La momentul actual există 43 de inhibitori kinazici aprobați pentru tratament în hemato-oncologie. Deși TKI nu sunt chiar niște „gloanțe magice”, așa cum s-a crezut la descoperirea imatinib, aceștia și-au demonstrat valoarea în cancere precum: cancerul pulmonar, melanom, de vezică urinară, GIST și cancere hematologice.
Cele mai comune mutații driver (EGFR, HER2, ALK, FGFR, BRAF) pot fi țintite cu ajutorul TKI. Au apărut tot mai mulți agenți care țintesc aceste mutații driver, dar și mutațiile ce conferă rezistență la tratament. Astfel, se descoperă tot mai mulți agenți terapeutici noi, TKI de generații noi, mai potenți și cu o selectivitate îmbunătățită, care tind să înlocuiască primele generații de TKI. Spre exemplu, osimertinib a devenit rapid tratamentul de primă linie pentru pacienții adulți cu cancer pulmonar non-microcelular (NSCLC) avansat local sau metastatic, cu mutații activatoare ale receptorului pentru factorul de creștere epidermal (EGFR). Acesta este un inhibitor potent al majorității mutațiilor EGFR, inclusiv al mutației T790M, cea mai comună și care se asociază cu apariția rezistenței la tratamentul cu TKI utilizați anterior (gefitinib, erlotinib).
Există exemple similare și pentru alte mutații, precum ALK. În ultimii ani au fost aprobate medicamente țintite pentru mutații foarte rare, precum NTRK. Testările acestor mutații au devenit fezabile odată cu introducerea în practică a panelurilor extinse de teste. Alte kinaze au fost de asemenea ținte terapeutice. Inhibitorii CDK4/6 au demonstrat creșterea supraviețuirii în cancerul de sân ER-pozitiv, asociați terapiei hormonale și sunt acum varianta de primă linie la pacienții cu boală avansată. Numeroase studii aflate în desfășurare vor permite extinderea indicațiilor pentru toți acești agenți terapeutici.
O altă țintă terapeutică o reprezintă inhibiția PI3K, ce aparține căii de semnalizare PI3K/AKT/mTOR cu rol important în creștere, metabolism și inițierea translației ADN. În prezent există 4 agenți aprobați, dar se așteaptă la o suplimentare a indicațiilor.
O altă arie de interes aflată în studii este eficacitatea acestor agenți ca tratamente adjuvante. Sunt aprobați până acum:
- dabrafenib (un inhibitor BRAF) în combinație cu trametinib (inhibitor MEK) în tratamentul melanomului cu mutație BRAF cu risc înalt;
- imatinib, pentru tratamentul tumorilor GIST la pacienții cu risc înalt;
- sunitinib, pentru cancerul renal, la pacienții cu risc înalt din SUA, dar nu și în Europa;
- neratinib, pentru cancerul de sân HER2-pozitiv, aprobat drept terapie adjuvantă după tratamentul cu trastuzumab, în urma datelor provenite din studiul Extenet.
În cancerul pulmonar EGFR-pozitiv, mai mulți agenți anti-EGFR nu au fost aprobați ca tratament adjuvant. Totuși, o meta-analiză care a inclus 11 studii sugerează puternic beneficiile aduse de acești agenți în comparație cu rezultatele la pacienții care nu au primit tratament, atât din punct de vedere al supraviețuirii fără progresie a bolii, cât și al supraviețuirii generale. Există studii în desfășurare cu osimertinib ca tratament adjuvant și nu ar fi surprinzător să apară rezultate pozitive, având în vedere beneficiile observate în boala metastatică.
Un alt domeniu aflat în atenția studiilor clinice îl reprezintă asocierea TKI cu inhibitori ai punctelor de control sau alte tipuri de agenți terapeutici. Cele mai convingătoare date care au condus la aprobare au fost prezentate în urma studiului Keynote-426 – combinația axitinib+pembrolizumab ca tratament de primă linie în cancerul renal avansat.
TKI sunt testați și în combinație cu inhibitorii de VEGFR, precum: ramucirumab în cancerul pulmonar EGFR pozitiv, unde combinația a fost superioară monoterapiei cu erlotinib.
În anii ce urmează vom vedea aprobări ale unor agenți terapeutici ale căror ținte nu au momentan niciun tratament disponibil personalizat. Recent au fost prezentate date promițătoare asupra: inhibitorilor RET, MET și EGFR.
Mai mult, există peste 150 TKI noi în studii clinice și mai multe molecule aflate încă în studii preclinice.
Anticorpii reprezintă de asemnea o piesă importantă în tratamentul cancerului. În prezent există peste 30 de agenți aprobați în hemato-oncologie, cu indicații ce variază de la boală metastatică, până la tratament adjuvant și de la monoterapie până la asociere cu alte medicamente. Peste 300 de agenți se află în studii clinice și mai mult de 30 deja în studii de fază III. În jur de 60 de agenți sunt conjugate anticorp-medicament (ADCs).
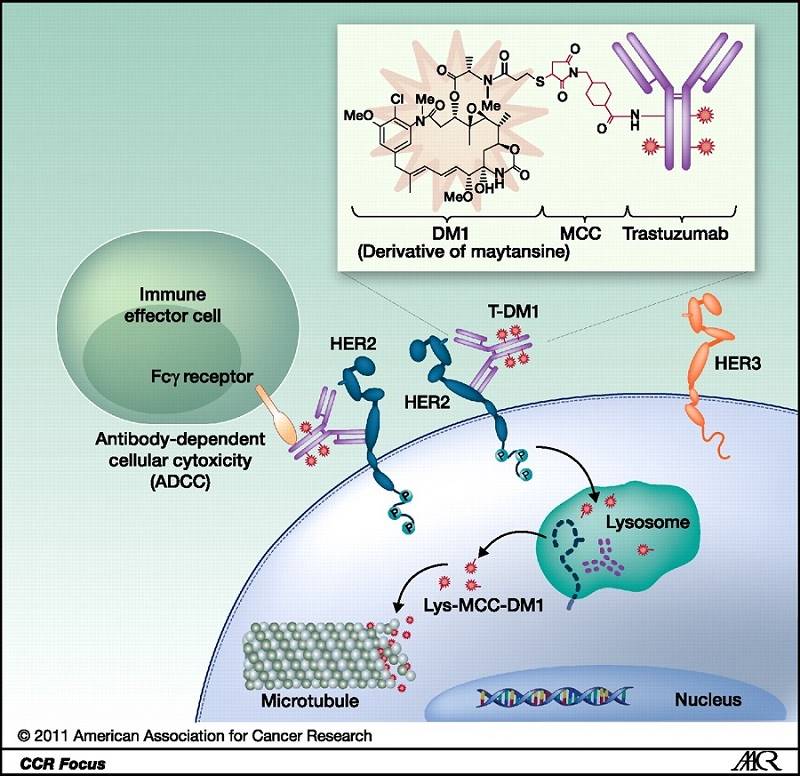
Există deja 4 ADCs aprobați: trastuzumab emtansine, brentuximab vedotin, gemtuzumab ozogamicin și inotuzumab ozogamicin. Noi agenți ADCs au demonstrat recent rezultate impresionante în cancere de sân și vezică urinară, astfel că ne așteptam la numeroase aprobări pentru această clasă terapeutică. Anticorpii bispecifici, multispecifici, nano-anticorpii și anticorpii mimetici reprezintă alte opțiuni promițătoare de tratament în oncologie, pentru care am putea vedea aprobări în viitor.
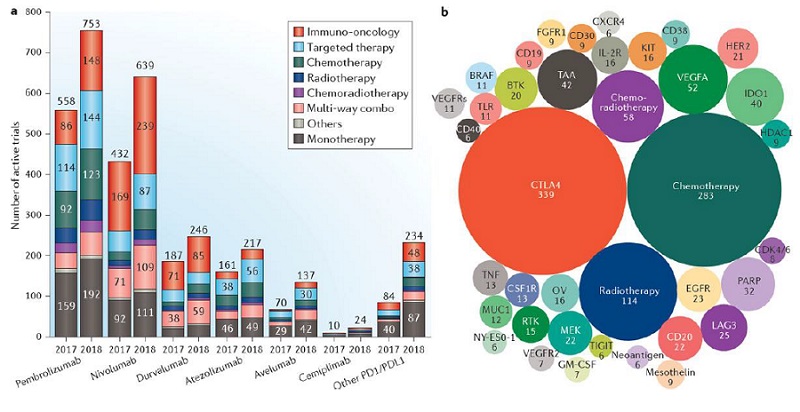
În ultimii 5 ani imunoterapiile joacă un rol important în tratamentul cancerului, fiind aprobate pentru indicații în multiple tumori solide. Unele indicații au ajuns rapid în prima linie de tratament sau ca terapie adjuvantă la pacienții cu melanom la risc înalt. Datele actuale indică faptul că se poate discuta de vindecare în cazul anumitor pacienți cu neoplasme chiar în stadii metastatice ale bolii.
Inhibitorii punctelor de control anti CTLA-4 (ipilumumab), PD-1 (pembrolizumab, nivolumab, cemiplimab) și PDL-1 (atezolizumab, durvalumab, avelumab) au fost aprobate cu indicații pentru numeroase malignități (melanom, carcinom pulmonar scuamos, adenocarcinom pulmonar, cancer urotelial, cancer de cap și gât, renal, colorectal, limfom Hodgkin, limfomul mediastinal primar cu celule B, adenocarcinom gastric, neoplasm cervical, carcinom scuamos cutanat, carcinom cu celule Merkel și mai recent, cancer esofagian).
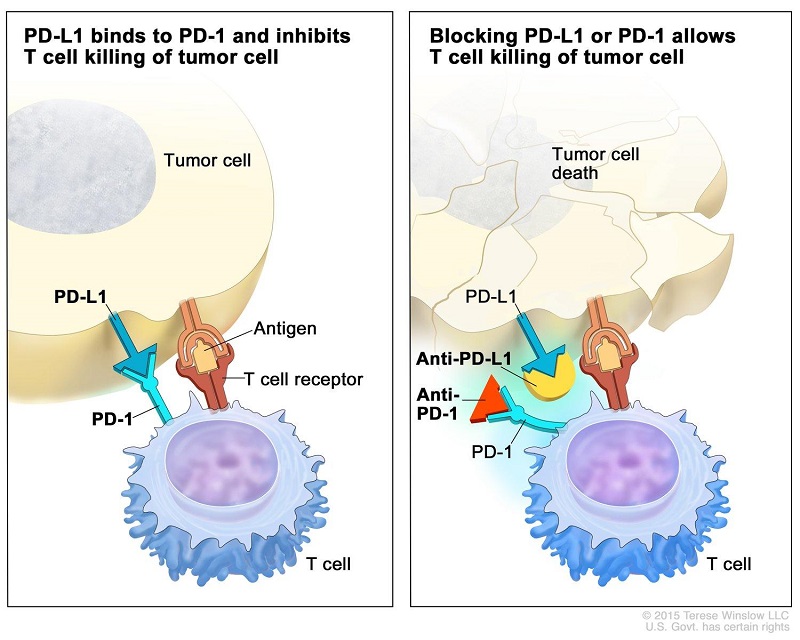
sursa: https://www.cancer.gov/
În ciuda acestor progrese, imuno-oncologia se află încă la început de drum. Mulți pacienți nu răspund la acești agenți terapeutici, fiind necesară o selecție mai bună a pacienților pe baza unor biomarkeri.
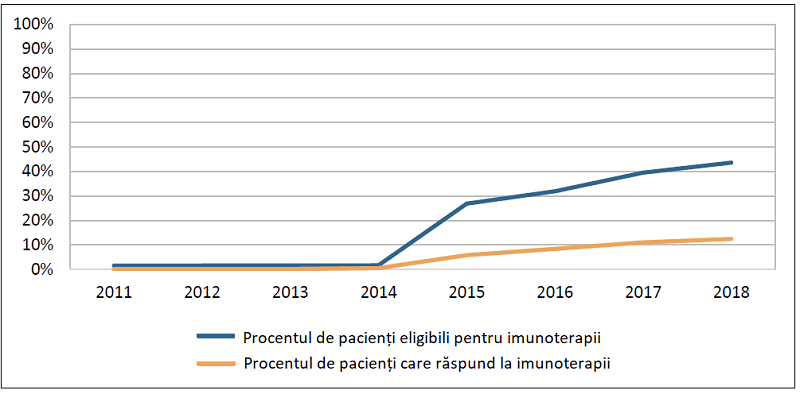
O altă provocare este determinarea beneficiilor diverselor combinații terapeutice. În prezent există în desfășurare peste 2000 de studii clinice ce au la bază imunoterapii ca monoterapie sau în combinație cu alte tratamente.
Terapiile celulare reprezintă una dintre cele mai noi metode de tratament, cu rezultate spectaculoase în cancerele hematologice. Există două terapii celulare aprobate la momentul actual împotriva CD19, Kymriah (tisagenlecleucel) și Yescarta, ambele cu indicații în tratamentul pacienților adulți cu limfom difuz, cu celulă mare de tip B, recidivant sau refractar (DLBCL), după două sau mai multe linii de terapie sistemică.
Ratele de răspuns sunt impresionante la acești pacienți pretratați, dar există de asemenea și probleme legate de reacțiile adverse.
Numeroase terapii celulare se află în studii și multe vor fi probabil aprobate în viitorul apropiat. Sunt explorate și alte tipuri de terapii celulare precum terapii cu celule stem hematopoietice, celule T reactive tumorale, celule NK, NKT și celule dendritice.
Deși au existat dubii în ceea ce privește beneficiul terapiilor celulare în tratamentul cancerelor solide, având în vedere faptul că acestea nu prezintă constant antigene (precum CD19 în malignitățile hematologice cu celule B), date recente ne arată un viitor promițător și în această arie a tumorilor solide.
Deși am văzut tot mai mulți agenți direcționați împotriva unor kinaze sau punctelor de control imun, cea mai mare parte a proteomului nu poate fi în prezent țintită specific. Noi clase terapeutice precum terapii genice, viroterapie oncolitică, diverse terapii celulare, siARN, PROTAC vor putea acționa probabil asupra unor ținte la care în prezent niciun tratament nu poate ajunge în mod specific.
Prima terapie genică, Zolgensma (onasemnogene abeparvovec-xioi), a fost aprobată în 2019 pentru atrofia musculară spinală. Deși nu este vorba despre o indicație oncologică, această aprobare reprezintă un moment extrem de important în medicină.
De asemenea, există și o singură viroterapie oncolitică aprobată până în prezent (talimogene laherparepvec) și altele aflate în dezvoltare, inclusiv combinații cu inhibitori ai punctelor de control.
Citește și:
- Raport IHE. Cancerul în Europa: mai multe cazuri diagnosticate, dar și mai mulți supraviețuitori. Inovația face diferența, dar există diferențe între Est și Vest în materie de acces
- Planul European pentru Cancer: consultarea publică, lansată în Parlamentul European. Care sunt principalele direcții? Ce spun președintele Comisiei Europene și comisarul european pentru sănătate?
- Unu-la-unu cu Dr. Marius Geantă: Dr. Mor Moscovitz, despre testarea comprehensivă genetică în cancerul pulmonar. Când și cum testăm biomarkerii?

