Studiul HERITAGE: Biosimilarul trastuzumab-dkst dovedește eficacitate și siguranță în tratamentul cancerului mamar metastazat HER2-pozitiv
Ogivri (trastuzumab-dkst) a dovedit similaritatea cu medicamentul de referință, trastuzumab (Herceptin), în cadrul studiului clinic HERITAGE. Datele pe termen lung au arătat că cele două medicamente biologice au același profil de eficacitate (supraviețuire globală similară) și siguranță în tratamentul cancerului mamar și gastric HER2-pozitiv.
Studiul clinic HERITAGE
HERITAGE este un studiu clinic de fază III, multicentric, randomizat, dublu-orb, ce a urmărit comparativ eficacitatea și siguranța biosimilarului Ogivri (trastuzumab-dkst) versus trastuzumab – produsul de referință (Herceptin).
Cele aproximativ 500 de paciente incluse în studiu prezentau cancer mamar metastazat, cu status HER2-pozitiv confirmat, și nu primiseră anterior chimioterapie sistemică sau trastuzumab. Pacientele au fost repartizate randomizat pentru a primi biosimilarul sau produsul de referință, în asociere cu docetaxel sau paclitaxel, pentru minimum 8 cicluri terapeutice. În ambele grupuri de tratament, trastuzumab a fost continuat ulterior până la progresia bolii, toxicitate intolerabilă sau deces.
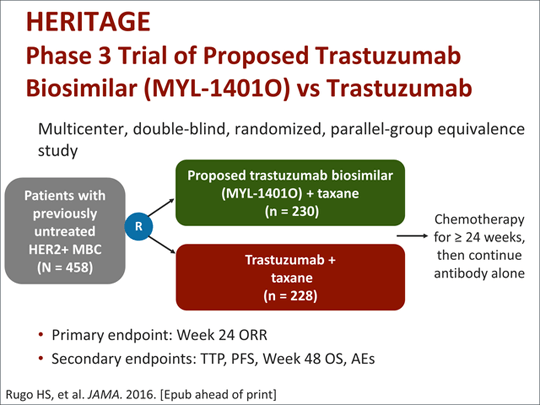
Eficacitatea a fost apreciată prin rata de răspuns global, definit conform criteriilor RECIST 1.1, evaluat în săptămâna 24 a studiului. În plus, au fost urmărite:
- supraviețuirea fără progresia bolii,
- supraviețuirea generală,
- siguranța.
Monitorizarea evoluției până la 36 de luni a relevat similitudine între profilurile de siguranță ale biosimilarului trastuzumab-dkst și produsului de referință. Nu s-au observat diferențe semnificative cu privire la toxicitate. Durata mediană a supravieţuirii fără progresia bolii a fost similară pentru cele două medicamente comparate (11,1 luni).
Despre trastuzumab
Terapiile biologice, incluzând anticorpii monoclonali, au îmbogățit opțiunile terapeutice și tratamentele pentru mai multe tipuri de cancer. Trastuzumab este un anticorp monoclonal IgG1 umanizat recombinant, anti-receptor al factorului uman de creștere epidermală 2 (HER2). Supraexprimarea HER2 este observată în 20–30% din cazurile de cancer mamar primar.
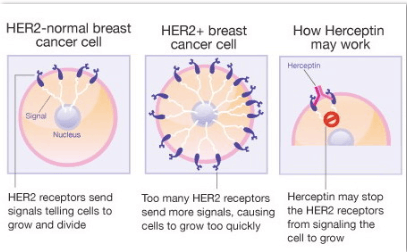
Trastuzumab este indicat în:
- cancerul mamar incipent HER2 pozitiv,
- cancerul mamar metastazat ce exprimă HER2 în exces,
- cancerul gastric metastazat HER2-pozitiv.
Testarea HER2 este obligatorie înainte de inițierea tratamentului. Trastuzumab poate fi prescris ca monoterapie sau împreună cu alte medicamente, sub supravegherea cadrelor medicale specializate. În asociere cu chimioterapia, ameliorează răspunsul global, supraviețuirea fără progresia bolii și supraviețuirea generală a pacienților.
Pacienții cu cancer mamar incipient trebuie tratați cu trastuzumab pe o perioadă de 1 an sau până la recidiva bolii. Pacienții cu cancer mamar sau gastric metastazat trebuie tratați cu trastuzumab până la progresia bolii.
Ogivri, trastuzumab biosimilar, este disponibil în România începând cu luna august 2019. Medicamentul și rezultatele studiului ce au dus la aprobare au fost prezentate în cadrul unui eveniment care a avut loc la Barcelona cu ocazia Congresului European de Oncologie (ESMO 2019).

Utilizarea medicamentelor biosimilare
Un biosimilar este un medicament biologic foarte asemănător unei terapii biologice de referință, deja aprobate. Din cauza modului de producere, un biosimilar nu poate fi identic cu medicamentul de referință.
Biosimilarele sunt autorizate conform standardelor privitoare la calitatea, siguranța și eficacitatea produselor farmaceutice aplicabile tuturor medicamentelor biologice. Dacă în fabricarea biologicului original atenția se îndreaptă în studiile clinice asupra siguranței și eficacității medicamentului, pentru biosimilare trebuie probată similaritatea cu originalul din punct de vedere al structurii, compoziției și activității in vitro.
Agenția Europeană pentru Medicamente (EMA) este responsabilă pentru evaluarea solicitărilor de comercializare a biosimilarelor în Uniunea Europeană. În urma aprobării, monitorizarea biosimilarului este strictă pentru a detecta posibile reacții adverse necunoscute. Biologicele și biosimilarele pot fi considerate opțiuni terapeutice sigure și eficace dacă sunt folosite în mod adecvat, la recomandarea medicului, conform indicațiilor.
Citește și:
- #ESMO18: Trastuzumab, date noi despre eficiență și siguranță
- FDA a finalizat ghidul pentru medicamentele biosimilare interschimbabile
- Săptămâna Europeană a Biotehnologiei 2019: Simpozionul „Valoarea adăugată a biotehnologiei și medicamentelor biologice în sistemul de sănătate din România”

