EMA facilitează implicarea grupurilor de pacienți în procesul de evaluare a noilor medicamente încă de la început
Comitetul pentru Produse Medicale de Uz Uman (CHMP) al Agenției Europene a Medicamentului (EMA) modifică modul în care sunt implicate organizațiile de pacienți în procesul de evaluare a medicamentelor, aceștia fiind consultați încă de la începutul analizei noilor cereri de autorizație de punere pe piață (Marketing Authorisation Applications, MAAs). În scopul de a îmbunătăți interacțiunea cu reprezentanții pacienților, CHMP propune în faza pilot de modificare a procesului ca organizațiile pacienților să fie consultate în fazele inițiale ale evaluării noilor MAAs, și nu în fazele finale, cum se întâmpla până în prezent. Astfel, pacienții își vor putea exprima într-o etapă inițială opinia asupra unor aspecte importante legate de calitatea vieții, opțiunile de tratament și nevoile medicale nesatisfăcute. Experiențele, perspectivele și îngrijorările pe care pacienții le împărtășesc vor putea fi astfel integrate în timp util în evaluarea cererilor de autorizație de punere pe piață pentru medicamentele noi.
Acțiunea propusă este în concordanță cu obiectivul planului de lucru al CHMP, acela de a încorpora preferințele pacienților în analizele de risc-beneficiu, precum și cu recomandările din strategia de reglementare a EMA, care evidențiază nevoia de integrare sistematică a datelor legate de pacienți în procesul decizional.
Comitetul CHMP recunoaște valoarea adusă de includerea perspectivelor pacienților în procesul de analiză a MAAs, pacienții fiind deja consultați în diverse faze ale evaluărilor. Totuși, autoritatea de reglementare europeană consideră că o consultare tardivă cu asociațiile de pacienți poate însemna pierderea oportunităților de integrare a perspectivelor consumatorului în procesul de evaluare.
Cum se va desfășura procesul propus, în etapa pilot?
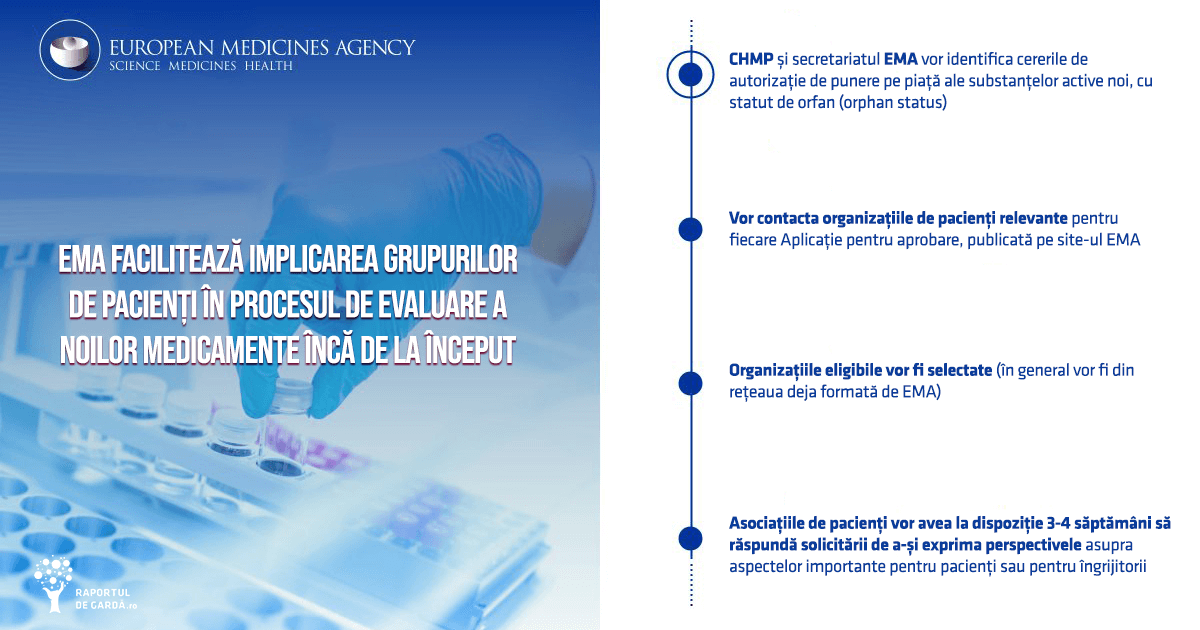
CHMP și EMA vor identifica cererile de autorizație de punere pe piață ale substanțelor active noi, cu statut de orfan (orphan status), pentru care procesul de evaluare urmează să fie inițiat și vor contacta organizații de pacienți relevante pentru fiecare MAA publicată pe siteul EMA. În general, acestea vor face parte din rețeaua deja formată a EMA de organizații eligibile de pacienți sau consumatori din Uniunea Europeană (UE) și vor fi selectate în concordanță cu aria terapeutică detaliată de fiecare MAA. Excluzând ceea ce va fi publicat pe siteul EMA, nu vor fi împărtășite alte date sau documente confidențiale cuprinse în cererile de autorizație de punere pe piață.
Asociațiile de pacienți vor avea la dispoziție 3-4 săptămâni să răspundă solicitării de a-și exprima perspectivele asupra aspectelor importante pentru pacienți sau pentru îngrijitorii acestora, cum ar fi calitatea vieții, variantele terapeutice și acceptabilitatea acestora, nevoile medicale sau terapeutice nesatisfăcute, ce beneficii ar aștepta de la noile medicamente, precum și efectele secundare pe care le-ar considera acceptabile. Organizațiile pacienților vor fi notificate, pe baza datelor publicate, asupra evoluției procesului de evaluare și contactate în cazul în care apar oportunități suplimentare de implicare în proces.
Modul în care va fi evaluată faza pilot
Etapa pilot va dura aproximativ un an, iar o analiză intermediară va fi efectuată la 6 luni de implementare pentru a înțelege beneficiile aduse de implicarea timpurie a pacienților în evaluarea medicamentelor noi. Fezabilitatea și valoarea fazei pilot va fi evaluată prin multiple chestionare completate de părțile implicate în proces, precum:
- chestionare de feedback pentru raportori și lideri de proiect ai CHMP care explorează contribuția și valoarea informațiilor oferite de pacienți;
- chestionare de feedback pentru organizațiile de pacienți care investighează perspectivele lor asupra colectării și împărtășirii de informații relevante cu CHMP.
De asemenea, pilotul va trebui să considere modul în care interacțiunea cu organizațiile de pacienți va putea fi înregistrată ca parte a unor acțiuni viitoare pentru a se asigura de integrarea contribuțiilor pacienților pe parcursul întregii evaluări.
La finalizarea etapei pilot, un raport va fi prezentat către CHMP și Grupului de Lucru al Pacienților și Consumatorilor (Patients and Consumers Working Party, PCWP), care va include feedbackul de la CHMP, lecțiile învățate, aspectele organizatorice, ariile care necesită îmbunătățiri și o propunere de implementare completă, dacă rezultatele obținute în faza pilot susțin acest lucru.
Citește și:
- Transparența, principiu fundamental în activitatea EMA: Curtea de Justiție Europeană confirmă dreptul de acces la informațiile pe care se bazează aprobarea unui medicament în UE
- Primii pași către înființarea unei asociații române a pacienților cu astm
- Cum se acordă autorizarea condiționată de punere pe piață în Uniunea Europeană pentru vaccinurile împotriva COVID-19?

