Raportul „Unlocking the potential of precision medicine in Europe”: accesul redus la testarea biomarkerilor în UE limitează implementarea medicinei de precizie în oncologie. Care este situația României?
Progresele în înțelegerea cancerului din ultimii 20 de ani au fost fundamentale, evidențiind o mare variabilitate între pacienți, chiar și în cadrul aceluiași tip de cancer, și subliniind necesitatea de a adapta îngrijirea cancerului la caracteristicile pacientului. Medicina de precizie, o abordare medicală care utilizează sistematic datele pacienților pentru a informa deciziile de tratament personalizate, are un potențial transformator – ofertă promisiunea unor rezultate superioare ale tratamentului pentru pacienții oncologici.
Medicina de precizie este susținută de progrese semnificative în testarea biomarkerilor – secvențierea de nouă generație (Next generation sequencing – NGS) permițând detectarea alterărilor genomice care determină dezvoltarea tumorii și oferind informații critice despre probabilitatea unui pacient de a răspunde la tratament. Însă medicina de precizie nu poate fi realizată, rămâne un concept pur teoretic și își pierde valoarea în lipsa testării.
Deși progresele în testarea biomarkerilor au un impact transformator asupra îngrijirilor oncologice, Europa va trebui să depășească bariere semnificative în accesul echitabil și calitatea acestor teste pentru a-și atinge potențialul complet. Aceasta este concluzia unui nou studiu lansat de Rețeaua internațională de calitate în patologie (IQN Path), Coaliția europeană a pacienților cu cancer (ECPC) și Federația Europeană a Industriilor și Asociațiilor Farmaceutice (EFPIA): „Unlocking the potential of precision medicine in Europe” – Improving cancer care through broader access to quality biomarker testing (Policy recommendations).
Studiul prezintă rezultatele cercetărilor efectuate în 2020 care au evaluat disponibilitatea, calitatea și rambursarea testelor de biomarkeri în UE 27 și Regatul Unit, identificând deficiențele specifice fiecărei regiuni și elaborând recomandări pentru îmbunătățirea accesului echitabil și a calității testării biomarkerilor în Europa.
„Progresele în înțelegerea cancerului din ultimele două decenii și descifrarea genomului uman au alimentat descoperiri puternice și au fost fundamentale pentru a ne duce la acest punct în care se poate adapta tratamentul cancerului pentru fiecare pacient. Deși s-au înregistrat progrese semnificative, rămân multe bariere. Disponibilitatea limitată a medicamentelor de precizie legate de biomarkeri, evaluarea neclară a valorii, lipsa infrastructurii de laborator și conștientizarea – toate aceste obstacole ne împiedică să profităm de beneficiile enorme ale testării biomarkerilor”, a declarat Nicola Normanno, președintele IQN Path și principalul investigator al studiului.

Testele de biomarkeri sunt instrumente esențiale în diagnosticul și tratamentul cancerului – pot fi utilizate pentru a oferi diagnostic precis și pentru a identifica pacienții cu cea mai mare probabilitate de a răspunde la tratament. Pe de altă parte, testarea moleculară joacă un rol cheie în determinarea și monitorizarea progresiei bolii și în identificarea pacienților cu risc crescut de a dezvolta o anumită afecțiune.
Astfel, identificarea biomarkerilor și dezvoltarea testelor corespunzătoare pentru aceștia au devenit din ce în ce mai importante în dezvoltarea de noi terapii. De exemplu, Food and Drug Administration a aprobat în iulie 2020 pembrolizumab (un anticorp monoclonal care blochează interacțiunea PD-L1 cu PD-1 și CD80) împreună cu testul FoundationOne CDx, pentru tumorile solide care prezintă markerul TMB-H, indiferent de localizare. Având în vedere complexitatea înțelegerii cancerului în era genomică, și capacitatea de testare trebuie să țină pasul – din ce în ce mai multe terapii sunt în prezent aprobate pe baza biomarkerilor caracteristici, și nu pe baza localizării primare a formațiunii maligne.
Datele colectate și evaluate în raport
Prin evaluarea unei selecții de biomarkeri cheie în funcție de patru variabile de acces (accesul la laboratoare, disponibilitatea testelor, rambursarea testelor, rapiditatea eliberării rezultatelor) și trei valori de calitate (participarea la schema de calitate, acreditarea laboratoarelor și timpul de răspuns), studiul a constatat că accesul la testarea de calitate a biomarkerilor oncologici este inconsecvent în Europa și contribuie semnificativ la inegalitățile în materie de îngrijiri de sănătate atât în interiorul, cât și între țări.
Țările Europei de Nord și de Vest au, în general, performanțe bune în testarea biomarkerilor, reflectând investițiile lor mai mari în asistență medicală. Țările din Europa Centrală și de Sud, precum și țările baltice tind să aibă o mai mare variabilitate în ceea ce privește accesul la infrastructura de testare și finanțare. Țările din Europa de Est necesită modificări structurale semnificative pentru a obține echitatea în accesul la testarea biomarkerilor.
Aprobarea paralelă a medicamentelor și a testării asociate, adoptarea unui sistem național de evaluare a calității testelor, bugete dedicate testelor de biomarkeri, educarea părților interesate, colectarea centralizată a datelor și scanarea orizontului (horizon scanning) pentru identificarea tendințelor și oportunităților se numără printre recomandările pe termen scurt prezentate în studiu. În ceea ce privește realizarea viziunii pe termen lung, studiul recomandă realizarea unei infrastructuri de testare centralizată, o abordare armonizată de-a lungul continuumului de dezvoltare a testelor, schimbul de date și elaborarea de ghiduri pan-europene privind testarea comprehensivă.
Situația României
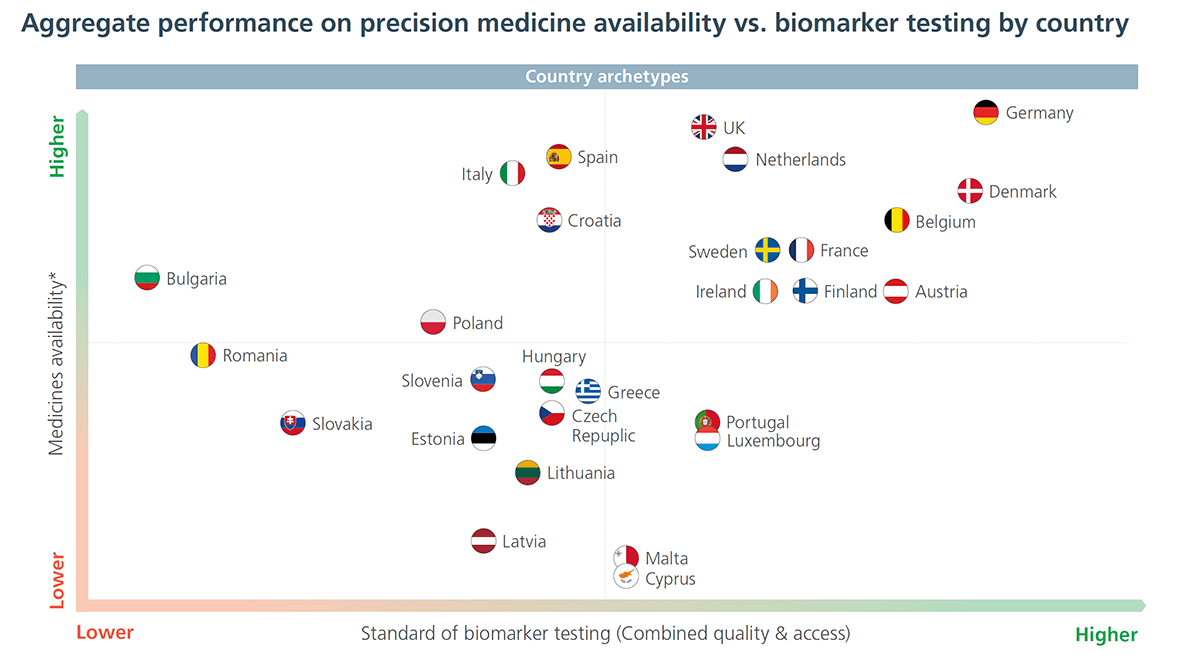
Punând împreună indicatorii utilizați: accesul la tratamente noi (lansarea comercială), accesul la testarea pe rând a biomarkerilor (single biomarker testing), accesul la testare comprehensivă a biomarkerilor și calitatea testelor efectuate, România se află în scenariul roșu – cu un acces scăzut la medicina de precizie pentru pacienții săi oncologici.
Deși din punct de vedere al accesului la tratamente noi, România înregistrează un nivel mediu, pentru restul indicatorilor menționați, nivelul este scăzut. Conform raportului, lipsa unui context care să demonstreze beneficiile clare aduse de testarea biomarkerilor este unul dintre factorii care împiedică acordarea fondurilor pentru testare. Pe de altă parte, lipsa educării specialiștilor cu privire la utilitatea testării este un alt factor care face ca, deși rambursarea să fie posibilă, testarea să nu fie totuși utilizată. În România, pacientul trebuie să se bazeze pe sprijinul companiilor farmaceutice când vine vorba despre testarea biomarkerilor, conform raportului.
Blocaje cheie:
- Valoarea neclară a testelor diagnostice
- Infrastructura neuniformă la nivel de laboratoare
- Educația limitată a stakeholderilor
- Disponibilitatea limitată la fonduri pentru testarea de biormarkeri
- Participarea inconsistentă cu privire la schemele de calitate și atestarea ISO a laboratoarelor
Pe termen scurt și lung, recomandările vizează patru domenii cheie:
- Rambursarea publică și suficientă a testelor, facilitată de un cadru clar de evaluare a valorii și calității acestora, atât pentru testele single-biomarker, cât și pentru cele multi-biomarkers
- Investiții în infrastructură, inclusiv investiții în colectarea centralizată a datelor clinico-genomice
- Educarea părților interesate
- Participarea consecventă la schemele europene de asigurare a calității, elaborarea de ghiduri împreună cu societățile europene (Ex. ESMO – Societatea Europeană de Oncologie Medicală) pentru cele mai bune practici
Recomandări la nivel național și european
Raportul recomandă crearea unei unități/ structuri specializate pentru medicina de precizie, care să aducă laolaltă toate părțile implicate și interesate la nivel național, pentru a influența rambursarea și organizarea testării. Scopurile unei astfel de structuri ar trebui să fie îndreptate către stabilirea de fonduri de rambursare a testelor comprehensive genomice (multi biomarker testing), facilitate prin crearea cadrelor bine definite în care această testare să aibă sens. Crearea de centre regionale de testare și investițiile în colectarea și centralizarea datelor ar trebui să fie de asemenea ținte importante. De asemenea, comitetul ar trebui să asigure educarea părților implicate și să instituie obligativitatea laboratoarelor să participe în schemele de calitate de la nivel internațional.
Mai mult, consorțiul/ structura specializată de la nivel național ar trebui să se alăture unei organizații mai mari la nivel european, care ar avea rolul de a: monitoriza și ghida inițiativele naționale, coordona inițiativele pan-europene, având în vedere obiective pe termen lung (un cadru standardizat pentru a evalua calitatea testărilor și valoare adusă în îngrijire, coordonarea de partajare a datelor și crearea de ghiduri pan-europene de practică pentru testarea comprehensivă).
Testarea pe rând a biomarkerilor (single biomarker testing) reprezintă testarea prezenței unei singure mutații genetice, a unei expresii genetice sau proteice, dintr-o probă de biopsie asociată cu o formă particulară de cancer (de exemplu HER2 pentru cancerul de sân). Acest tip de testare include și imunohistochimia (IHC), hibridizarea fluorescentă in situ (FISH) și testarea PCR.
Testarea comprehensivă genomică (multi biomarker testing): înseamnă utilizarea testelor genomice complexe (NGS) pentru detectarea de multiple alterări genetice despre care se cunoaște că influențează dezvoltarea tumorală. NGS poate fi utilizată atât pentru secvențierea întregului genom, cât și pentru arii specifice de interes și poate fi utilizată în paralel cu testarea simplă genetică.
Testarea biomarkerilor reprezintă o punte către accesarea terapiilor de precizie, deoarece pentru a putea fi prescrise, pacienții trebuie să fie testați. Întârzierea în implementarea testării duce la restricționarea, de fapt, a accesului la aceste terapii (chiar dacă ele sunt rambursate în sistem). Conform raportului, în majoritatea țărilor, testarea reprezintă una dintre limitările majore cu privire la medicina de precizie. Acest lucru se datorează diferenței foarte mari dintre rambursarea medicamentului la nivel național și rambursarea testului – comitete diferite se ocupă de cele două, iar în unele țări, nu există astfel de comitete specializate. Raportul nu recomandă ca procesul HTA să fie comun pentru medicamentele de precizie și teste, însă este nevoie de o abordare agregată și paralelă a celor două, deoarece dacă medicamentul este rambursat, dar pacientul trebuie să plătească testul sau să aștepte oportunități din partea companiilor farmaceutice, valoarea medicamentului în sine se pierde.
Citește și:
- FDA aprobă prima biopsie lichidă care utilizează tehnologia NGS și confirmă indicația de tratamente țintite în anumite forme de cancer pulmonar, prostatic, mamar și ovarian
- Raport IHE. Progrese în diagnosticul cancerului: cum au schimbat testarea genomică și biomarkerii standardul european?
- Indicele European de Medicină Personalizată: România, locul 32 din 34. Deficiențe în infrastructura digitală din sănătate și investiții scăzute în cercetare și dezvoltare

