Raport IHE. Progrese în diagnosticul cancerului: cum au schimbat testarea genomică și biomarkerii standardul european?
Modul de diagnosticare a cancerului s-a schimbat major în ultimele decenii datorită tehnologiilor noi care au permis studierea ADN, ARN și a altor alterări genomice care apar în celulele tumorale, și care pot beneficia de terapii țintite. Progresul înregistrat în domeniul de diagnostic oncologic a permis evaluarea gradului de răspuns la tratament a pacienților. Tehnologiile noi permit caracterizarea modificărilor genetice și astfel, depistarea biomarkerilor care indică utilitatea tratamentelor țintite.
Oncologia este principala arie medicală care beneficiază de abordarea personalizată. Biomarkerii se află la baza diagnosticului precis al cancerului și reprezintă trăsături biologice, care pot fi moleculare, anatomice, fiziologice sau biochimice. Aceste trăsături pot fi măsurate și evaluate obiectiv, devenind indicatori ai unui proces biologic normal sau patologic. În funcție de rol, biomarkerii pot fi: de diagnostic, de risc, de prognostic (favorabil sau agresiv), de predicție a gradului de răspuns sau toxicitate la tratament.
Biomarkerii asociați cu mai multe tipuri de cancer pot fi identificați prin teste specifice. Sunt necesare testări complexe pentru a identifica pacienții potriviți pentru a beneficia de diverse combinații terapeutice sau de terapii celulare. Acest lucru conduce către costuri ridicate, astfel încât sunt necesare îmbunătățiri pentru eficientizarea rezultatelor și/sau reducerea efectelor adverse asociate metodelor de diagnostic.
Tehnologiile mai vechi și mai puțin costisitoare, precum PCR (reacție de polimerizare în lanț) și FISH (hibridizare fluorescentă in situ), sunt din ce în ce mai des înlocuite de metode mai complexe, care permit analiza simultană a unui număr mai mare de gene (NGS – secvențiere de nouă generație). Avantajul NGS este că materialul tumoral necesar este de obicei redus cantitativ și permite testarea mai multor modificări genetice pentru a detecta pacienții care pot beneficia de terapii țintite, personalizate. Performanța și modul de raportare al rezultatelor NGS diferă într-o oarecare măsură deoarece se folosesc tehnologii și tehnici diferite. Cu toate acestea, analizele comparative ale platformelor NGS au demonstrat că rezultatele sunt relativ similare.
Cel mai probabil, testarea PCR se va folosi în continuare în cazurile în care există puține modificări genetice la nivelul cărora se poate acționa. Panelurile PCR extinse, care permit studierea mutațiilor de la nivelul mai multor gene, ar putea fi o opțiune în cazul pacienților care nu sunt eligibili pentru studii clinice, precum și în situații în care testarea NGS este prea costisitoare (de exemplu, în anumite țări sau în anumite subtipuri tumorale). Avantajele testării PCR sunt: specificitatea în amplificările secvențelor țintite ale fragmentelor ADN, costul redus, accesibilitatea, rapiditatea în efectuarea analizei, faptul că este recomandată în unele ghiduri pentru a alege terapiile țintite aprobate de FDA.
De câțiva ani este posibilă detectarea prin biopsie lichidă a modificărilor de la nivelul unei singure gene. Scăderea costurilor NGS și îmbunătățirea posibilităților bioinformatice a permis dezvoltarea panelurilor extinse de detecție a mutațiilor prin biopsie lichidă, însă acestea se folosesc în special în studiile clinice și în cazuri selecționate, în care este dificilă recoltarea biopsiilor. Principala utilitate clinică a diagnosticării prin biopsie lichidă este înțelegerea mecanismelor de rezistență dobândită, mai ales în cazul cancerului pulmonar non-microcelular unde recoltarea unei biopsii tisulare noi este dificilă.
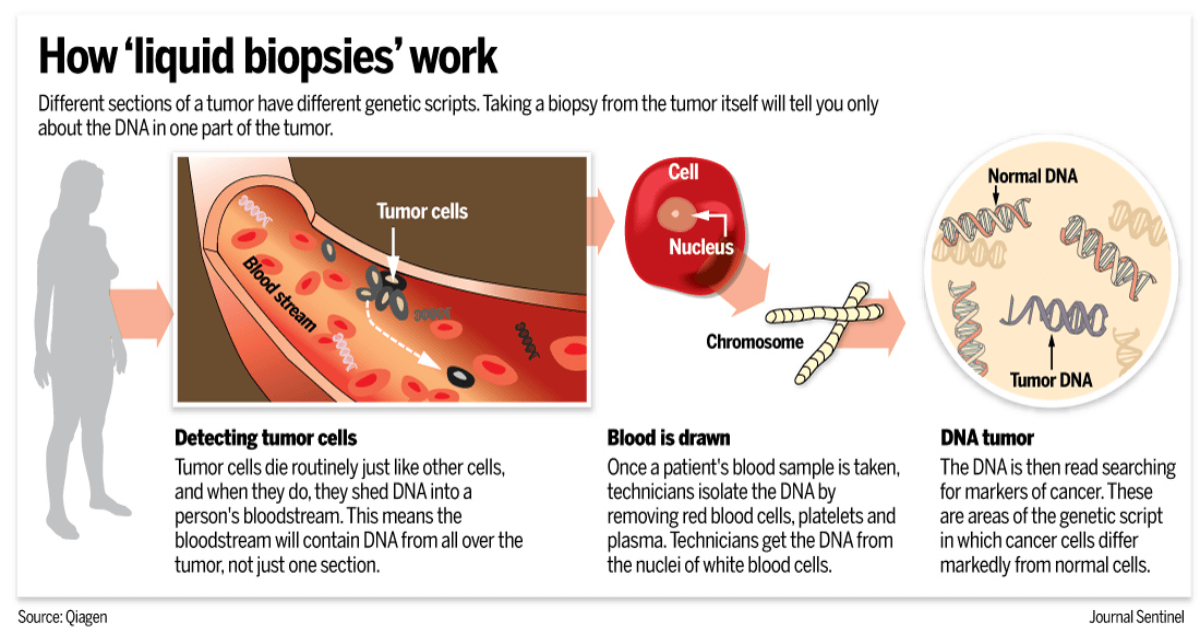
Sensibilitatea biopsiei lichide îi limitează utilitatea la pacienții cu boală metastatică (sensibilitate de 75-85%). În prezent se fac încercări pentru a evalua diverse tehnologii care să permită o monitorizare și detecție precoce a răspunsului / lipsei de răspuns în etapa metastatică. Este posibil ca în viitor să vedem implementată în practica clinică detecția factorilor circulatori precum: celule tumorale, exosomi, mutații ale ADN-ului tumoral circulant, micro-ARN, proteine.
Se fac eforturi pentru dezvoltarea de teste care să aducă beneficii clinice în fazele incipiente ale bolii și pentru detecția precoce, prin combinarea mai multor parametri. Sensibilitatea pentru a detecta stadiul I al cancerului este încă limitată, deși se consideră ca detecția bolii prin biopsie lichidă se asociază cu un prognostic mai nefavorabil. Biopsia lichidă ar putea avea un rol important în detecția fazelor incipiente ale bolii în cazul bolii minime reziduale. Acești pacienți ar putea beneficia în continuare de tratamente și este posibil ca în viitor să fie aprobate medicamente pentru boala minimă reziduală definită pe baza biopsiei lichide.
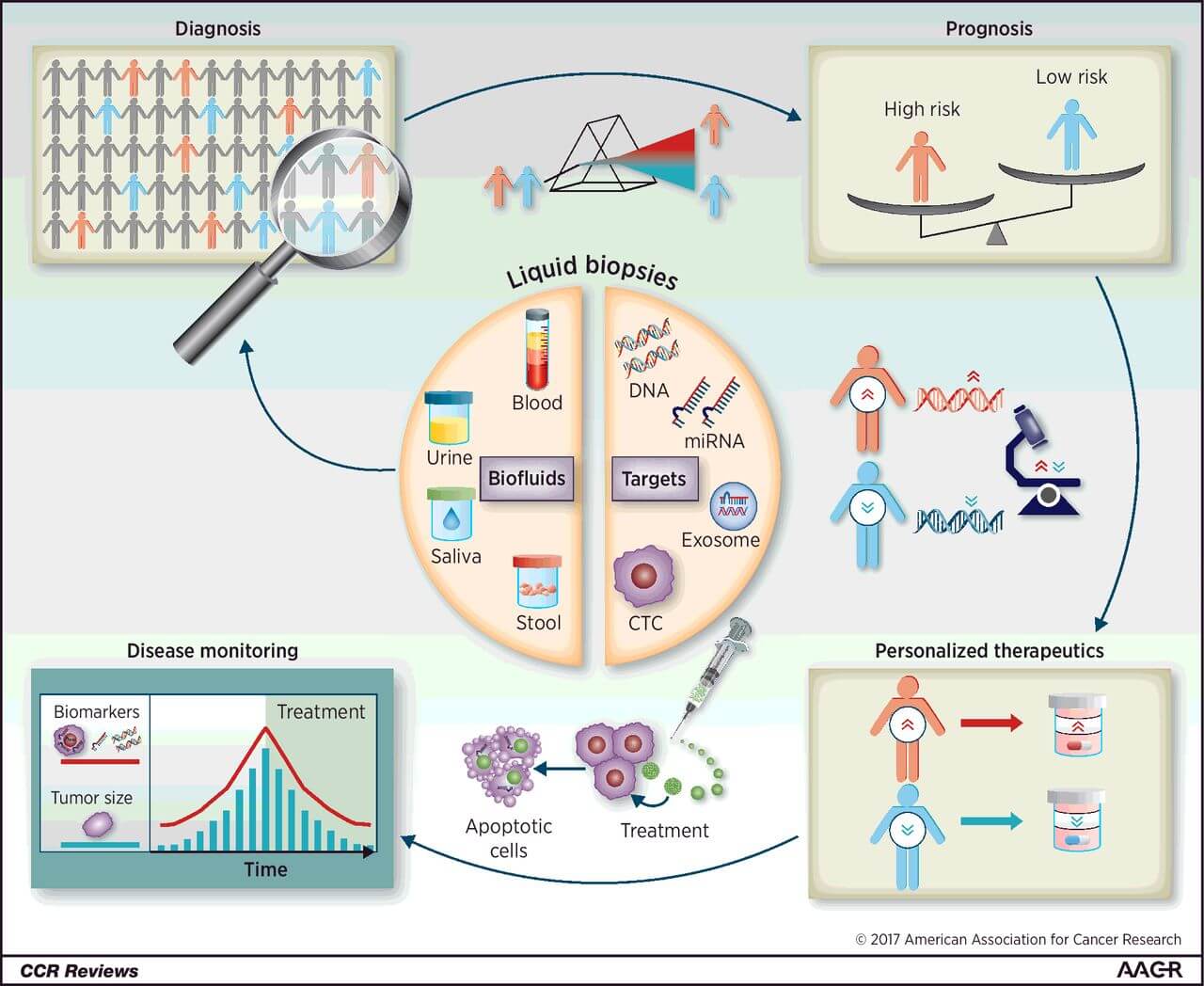
Analiza expresiei genice s-a dovedit valoroasă în unele indicații (cancer mamar, colorectal, de prostată, renal) însă cu implicații clinice variate. Mai multe teste au fost dezvoltate pentru a evalua prognosticul bolii, însă datele arată că algoritmii folosiți de fiecare test clasifică pacienții în mod diferit, ceea ce face dificilă standardizarea.
În prezent se dezvoltă teste care utilizează și alte probe, precum: salivă, urină, materii fecale. Testul Cologuard de screening noninvaziv al cancerului colorectal reprezintă un avans semnificativ, având o specificitate de 87%. Cel mai probabil, în viitor vom vedea astfel de investigații folosite și în alte indicații. Testele ar putea fi compuse și ar putea evalua mai multe variabile, de la acizii nucleici până la microbiom, care pare să aibă implicații importante în unele situații.
Apariția imunoterapiilor se află în strânsă legătură cu cercetările asupra biomarkerilor, precum: instabilitatea microsatelitară înaltă (MSI-H, care a fost aprobată de către FDA drept biomarker), sau încărcătura mutațională înaltă (TMB, care este în curs de validare), IFN-gamma, TGF-beta, celulele imune stromale, epitopii neoantigenelor, expresia clasei MHC I, haplotipul HLA, mutațiile JAK1/JAK2, beta-2-microglobulina, NF1, algoritmi de expresie genică, microbiota intestinală.
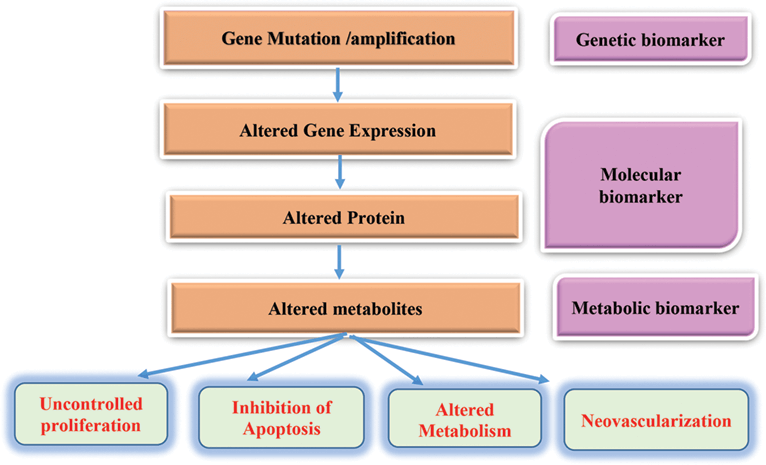
Este necesară o mai bună înțelegere a mutațiilor și a căilor implicate în oncogenetică, precum și a mecanismelor care permit tumorii să evite răspunsul sistemului imunitar, deoarece datele arată că activarea căilor oncogenetice conduce către afectarea sistemului imunitar. Va fi nevoie de efort semnificativ în următorii ani pentru a defini și valida biomarkeri care să permită selecția pacienților în vederea unui management personalizat.
Raportul IHE: Cancerul în Europa
Cancerul rămâne una dintre principalele și cele mai discutate probleme de sănătate publică la nivelul Europei. Povara bolii este în continuă creștere atât pentru pacienți, cât și pentru sistemele de sănătate, deoarece oamenii trăiesc mai mult datorită progreselor înregistrate în alte arii ale medicinei. În același timp, datorită evoluției la nivel științific, și în special datorită noilor imunoterapii, în unele cazuri cancerul s-a transformat dintr-o boală fatală într-o afecțiune cronică, apărând noi provocări care trebuie adresate.

Scopul raportului „Comparator Report on Cancer in Europe 2019”, realizat de către IHE (The Swedish Institute for Health Economics) este de a oferi decidenților o imagine clară asupra situației cancerului la nivelul Europei, astfel încât să faciliteze crearea unor planuri și acțiuni de reducere a poverii bolii. Acest raport ar poate constitui o bună bază pentru Planul european de control al cancerului, care a fost anunțat pe 4 februarie 2020, în Parlamentul European. Ediția 2019 a IHE Report este o actualizare a precedentelor rapoarte comparatoare pe tema cancerului, realizate în perioada 2005-2016.
Citește și:
- Raport IHE. Cancerul in Europa: mai multe cazuri diagnosticate, dar și mai mulți supraviețuitori. Inovația face diferența, dar există diferențe între Est și Vest în materie de acces
- Raport IHE. Cancerul în Europa: care este situația programelor de screening la nivel european și ce măsuri pot fi luate pentru îmbunătățirea lor?
- Raport IHE. Povara economică a cancerului: costurile directe au crescut cu 98% din 1995 până în 2018, în UE. România alocă cea mai mică sumă pe cap de locuitor

