CAR-T, tratamentul oncologic creat pentru fiecare pacient în parte: care sunt provocările pentru extinderea utilizării terapiilor celulare în practică?
Imunoterapia câștigă teren în oncologie, pe măsură ce noi tratamente se impun și demonstrează superioritate față de ceea ce se considera standardul terapeutic. Dacă inhibitorii punctelor de control au reprezentat o descoperire care a revoluționat tratamentul oncologic prin blocarea mecanismelor folosite de celulele tumorale pentru a scăpa de sub recunoașterea de către componentele sistemului imun, terapiile CAR-T aduc o nouă perspectivă în personalizarea tratamentului. Limfocitele T sunt modificate genetic pentru a crește răspunsul imun împotriva unor antigene specifice.
Studiile clinice vizând terapiile CAR-T demonstrează atingerea unor obiective care anterior păreau imposibile – rate de remisiune de până la 94% pentru forme grave de cancere hematologice. Răspunsurile sunt cu atât mai impresionante cu cât pacienții care participă la aceste studii de obicei fac parte din categoriile pentru care resursele terapeutice s-au epuizat.
Peste 800 de studii clinice care evaluează terapiile CAR-T sunt în dezvoltare. Terapiile CAR-T au deschis noi orizonturi în oncologie dar se și lovesc de o serie de provocări. Costurile ridicate pentru producerea tratamentului, numărul limitat de cazuri pentru care sunt indicate, controlul efectelor adverse sunt doar câteva dintre problemele actuale.
Accesul rapid pe scară largă la o terapie inovatoare
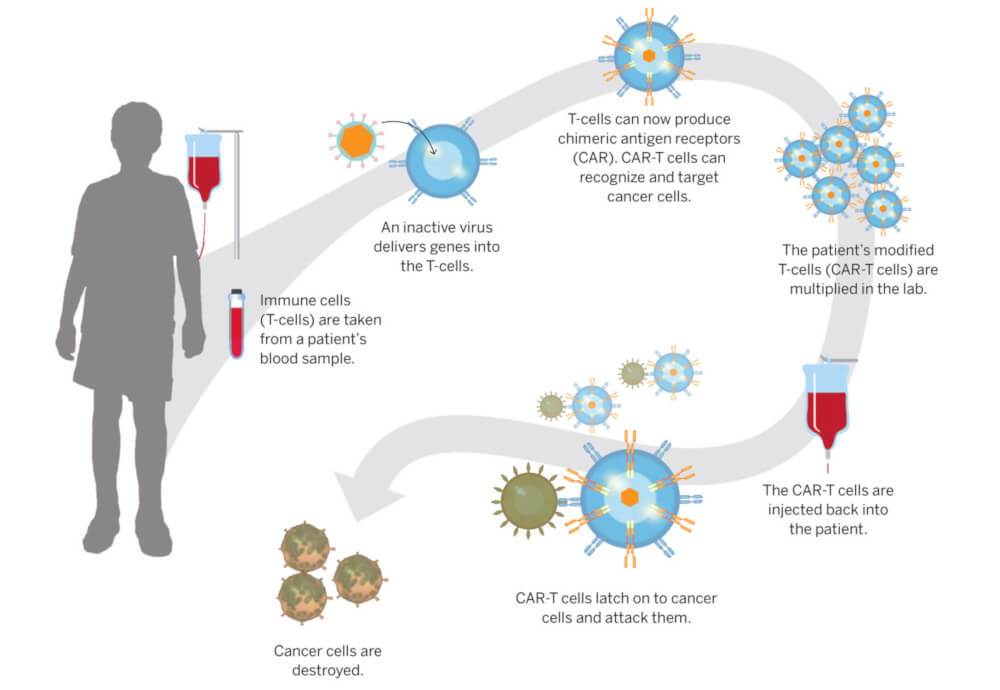
Până acum, terapiile CAR-T au fost obținute pe baza prelucrării celulelor pacientului – metode de tip autolog, ceea ce înseamnă că fiecare terapie trebuia să fie specifică fiecărui pacient, o terapie înalt personalizată. Aceasta reprezintă, însă, o barieră în calea obținerii unui tratament pe scară largă.
Introducerea unor tehnici complexe în multiple centre, pregătirea personalului medical, trasabilitatea sunt încă subiecte discutate.
Pentru obținerea unui tratament autolog sunt necesare între 3 și 4 săptămâni. Celulele pacientului sunt prelevate, transportate la un laborator specializat, modificate genetic pentru a exprima receptorul CAR iar produsul final se întoarce în centrul în care se administrează tratamentul. În cazul pacienților cu boală avansată sau cu boală rapid progresivă vor fi necesare noi strategii pentru asigurarea accesului rapid la tratament.
O nouă dimensiune explorată ar fi aceea a terapiilor CAR-T de tip allogen sau „off the shelf”, care pot fi obținute de la donatori sănătoși și utilizate la nevoie. În aceste cazuri sunt realizate modificări asupra celulelor pentru a elimina posibilitatea apariției reacției de respingere a tratamentului.
Deja există studii în derulare care testează opțiunile off-the-shelf, iar primele date din studii pe subiecți umani indică lipsa unor toxicități severe.
Managementul reacțiilor adverse
Administrarea terapiilor CAR-T trebuie să fie urmată de o monitorizare adecvată, care să respecte protocoalele terapeutice.
Neurotoxicitatea și sindromul de eliberare de citokine reprezintă efecte adverse asociate terapiei celulare CAR-T și au potențial fatal în lipsa unei monitorizări adecvate a tratamentului. Terapiile direcționate împotriva antigenului CD19, primele care au apărut au fost și cele studiate pentru o perioadă mai lungă. S-au acumulat dovezi științifice care susțin faptul că balanța risc-beneficiu este favorabilă. De asemenea, noile generații de terapii celulare au un profil de siguranță mult mai bun. Există tehnologii în studiu care permit activarea celulelor T în momente specifice.
Kymriah este aprobată în UE pentru tratamentul pacienților copii și adolescenți și pacienților adulți tineri, cu vârsta cuprinsă până la 25 ani inclusiv, cu leucemie acută limfoblastică (LAL) cu celule B, refractar, în recădere post transplant, în a doua recădere sau recăderi ulterioare și pacienților adulți cu limfom difuz cu celulă B mare, recidivant sau refractar (DLBCL), după două sau mai multe linii de terapie sistemică. Yescarta este indicată pentru tratamentul adulților cu limfom difuz cu celulă B mare (DLBCL), refractar sau recidivat și pentru tratamentul limfomului primar mediastinal cu celulă B mare, după cel puțin două linii de terapie sistemică.
Pacienții oncologici care au primit multiple tratamente sistemice anterioare pot avea un status precar și nu pot fi expuși riscului unor posibile reacții adverse. De aceea, o categorie restrânsă de pacienți sunt eligibili – cei care au alte tratamente în antecedente realizate fără succes dar un status funcțional bun.
O metodă intens studiată este combinarea CAR-T cu un alt tip de tratament – inhibitorii punctelor de control. Utilizarea acestora permite accentuarea și menținerea beneficiilor terapiei celulare. După activarea limfocitelor T CD19, în timp, se poate pierde eficacitatea tratamentului iar o cale de semnalizare identificată în cadrul acestor mecanisme este cea care implică PD-1. Combinația cu inhibitorii PD-1 poate ameliora răspunsul în timp.
De asemenea, în studii preclinice s-a observat o scădere a eficienței terapiilor CAR-T în cazul tumorilor solide voluminoase. Inhibitorii punctelor de control au fost sugerați ca soluție având în vedere faptul că pe modele animale, tratamentul cu inhibitori PD-1 a dovedit capacitatea de reactivare a celulelor CAR-T și reducerea tumorilor.
Terapiile CAR-T, eficiente și în cazul tumorilor solide?
O terapie CAR-T pornește de la principiul de recunoaștere a unui antigen specific. Astfel, doar o categorie restrânsă de pacienți sunt candidați pentru un anumit tratament. Mai mult decât atât, la nivel tumoral apar mecanisme de evitare a detecției imune, ceea ce determină scăderea eficacității terapiei CAR-T. În cazul neoplasmelor solide abordarea terapeutică este și mai dificilă deoarece antigenele nu sunt exprimate la suprafața celulei.
În tumorile solide, puține celule T ajung să infiltreze țesutul, iar celulele tumorale contribuie la realizarea unui micromediu imunosupresiv.
Noile studii vizează tipuri speciale de terapii CAR-T care presupun exprimarea la nivelul limfocitului T a unor receptori care se găsesc în mod normal pe un alt tip de celulă a sistemului imun – celule natural killer. Acestor receptori le pot corespunde până la 8 tipuri diferite de liganzi care sunt exprimați de peste 80% dintre tumorile solide și hematologice. Astfel de terapii sunt în studiu pentru mai multe indicații, în prezent.
Transformarea sistemelor de sănătate
CAR-T nu constituie doar un tratament revoluționar pentru practica medicală și din perspectiva cercetării, ci impune o regândire a sistemelor de sănătate. Dacă provocările științifice sunt intens studiate, modalitățile de introducere pe piață și de a reglementa aceste tratamente se lovesc, de asemenea, de provocări. Autoritățile internaționale deja au schimbat în ultimii ani procedurile de evaluare și aprobare a terapiilor noi într-un ritm accelerat.
Terapiile CAR-T deja aprobate, Kymriah și Yescarta sunt considerate produse medicale bazate pe terapii avansate și complexe (ATMP). FDA a emis în 2017, 5 ghiduri noi destinate terapiilor genice și celulare. Cele două terapii celulare au fost aprobate prin procedură accelerată (fast track designation).
Agenția Europeană a Medicamentului a introdus programul PRIME (PRIority Medicines) pentru a sprijini dezvoltarea de tratamente care se adresează unor nevoi medicale neacoperite, cum este și cazul terapiilor CAR-T.
Un studiu publicat în JAMA Pediatrics a demonstrat că 40% dintre pacienții cu LAL-B, tratați cu tisagenlecleucel vor deveni supraviețuitori pe termen lung, aceștia răspund la tratament și după 5 ani. Până la introducerea acestei terapii, rata de supraviețuire fără recidivă a bolii la 5 ani era de doar 10-20%. În acest context, autorii studiului recomandă ca reglementările pentru rambursarea acestor terapii să țintă cont de beneficiile demonstrate de tratament.
Conform unei analize publicate de ICER (Institute for Clinical and Economic Review) în 2018, tisagenlecleucel demonstrează un beneficiu net pentru copiii cu leucemie acută limfoblastică de linie B, iar atât tisagenleceleucel cât și axicabtagen clioleucel aduc beneficii semnificative pentru tipuri specifice de limfom non-Hodgkin.
Începând cu 2020, în Statele Unite ale Americii, CMS a decis creșterea rambursării terapiilor celulare CAR-T de la 50% la 65%.
Politicile de sănătate înregistrează, însă, mari variații la nivelul diferitelor țări. Selecția pacienților, prelevarea limfocitelor, prelucrarea acestora, controlul calității sunt elemente de maximă importanță. Toate etapele procesului biotehnologic de obținere a terapiilor trebuie să fie bine reglementate. Medicii oncologi trebuie să selecteze pacienții eligibili pentru a primi o terapie CAR-T și să îi trimită la un centru specializat. În acest sens, informarea personalului medical și realizarea unor supraspecializări vor fi alte condiții indispensabile. De asemenea, cooperarea internațională și dezvoltarea unor politici sustenabile sunt alte aspecte care trebuie considerate de fiecare națiune care vrea să introducă un astfel de tratament.
Citește și
- Noile generații de terapii CAR-T: cele mai importante studii prezentate la ASH 201
- State of Innovation 2019. Terapiile celulare CAR-T: momentul actual și direcții viitoare
- Terapiile CAR-T, eficiente și în cazul tumorilor solide: primele rezultate pozitive în studii de faza I

